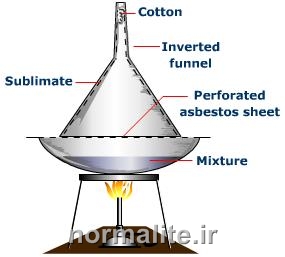
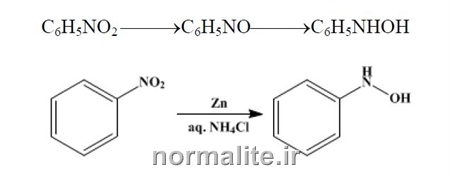
|
محلولسازی

روش ساخت محلول با غلظت معین
بسیاری از واکنشهای شیمیایی تنها در محیط آبی قابل انجام هستند و برخی دیگر در محیط آبی بهتر انجام میشوند و در نتیجه باید اجزای واکنش در آب یا حلال دیگری حل شود. دلیل این امر جنبش مولکولهای مایعات و تراکم خوب آن است که باعث میشود احتمال برخورد مولکولهای دخیل در واکنش زیاد شود و واکنش بهتر و سریعتر انجام شود.
احتمالاً در تصاویر قدیم، کیمیاگران را دیدهاید که مشغول ساختن محلولهای گوناگون و رنگارنگ هستند.

محلولسازی شامل حلشدن یک مادهی حلشونده (جامد، مایع، گاز) در یک مایع حلال است. حلال میتواند آب یا هر مایع دیگری باشد که قابلیت حلکردن حلشونده را داشته باشد. برای انجام آزمایشهای علمی لازم است مقدار دقیق حلشونده در حلال معلوم باشد. تیترسنجی، واکنشهای خنثیسازی و واکنشهای اکسیداسیون و احیا از جمله مواردی هستند که با محلولسازی سروکار دارند.
معرف تیمول فتالئین : 0.4 گرم تیمول فتالئین را در 600 میلی لیتر اتانول حل نموده و سپس 400 میلی لیتر آب مقطر اضافه نموده و محلول را هم بزنید تا یکنواخت شود و اگر رسوبی در محلول وجود داشت آنرا صاف نمائید.
معرف متیل اورانژ : 0.5 گرم معرف را در یک لیتر آب مقطر حل نمائید.
اسید کلریدریک 0.1 نرمال : 8.28 میلی لیتر اسید کلریدریک غلیظ را به حجم یک لیتر برسانید. یا یک عدد تیترازول 0.1 نرمال به حجم یک لیتر برسانید.
اسید کلریدریک 1 نرمال : 82.8 میلی لیتر اسید کلریدریک غلیظ را به حجم یک لیتر برسانید یا یک عدد تیترازول 1 نرمال به حجم یک لیتر برسانید.
محلول آب مقطر اسیدی : 20 میلی لیتر اسید کلریدریک را با 500 میلی لیتر آب مقطر مخلوط نمائید.
اسید کلریدریک 5 درصد : به ازای هر 5 میلی لیتر اسید کلریدریک، 95 میلی لیتر آب مقطر اضافه نمائید.
اسید کلریدریک 99+1 : به ازای هر یک میلی لیتر اسید کلریدریک، 99 میلی لیتر آب مقطر اضافه نمائید.
محلول اسید نیتریک 0.1 نرمال : 6.9 میلی لیتر اسید نیتریک غلیظ را به حجم یک لیتر برسانید.
محلول 0.1 نرمال سود : 1 گرم NaOH جامد را در آب مقطر حل نمـــوده و در یک بالن ژوژه 250 میلی لیتری به حجم برسانید.
محلول 10 گرم در لیتر سود : 10 گرم سود جامد را در آب مقطر حل نموده و به حجم یک لیتر برسانید.
محلول 4 نرمال KOH : مقدار 250 گرم KOH جامد را در آب مقطر حل نموده و به حجم یک لیتر برسانید.
محلول کلرور استانو : مقدار 5 گرم SnCl2.2H2O را در ده میلی لیتر اسید کلریدریک غلیظ حل نموده و حجم را با آب مقطر به 100 میلی لیتر برسانید. محلول را جوشانده تا رنگ آن شفاف شود، سپس مقداری قلع فلزی به آن اضافه کنید.
محلول دی کرومات پتاسیم 0.05 نرمال : یک عدد تیترازول 0.1 نرمال را به حجم دو لیتر برسانید یا جامد آن را بمدت 2 ساعت در اون در حرارت 120 خشک نموده و 2.4516 گرم را در آب مقطر حل کرده و حجم را به یک لیتر برسانید.
محلول نیترات نقره (جهت شناسائی حضور کلر و برای اطمینان از شستشوی رسوبات) : 17 گرم نیترات نقره را در آب مقطر حل نموده و حجم را به یک لیتر برسانید.
محلول نیترات آمونیوم 20 گرم در لیتر (NH4NO3) : مقدار 20 گرم نیترات آمونیوم را در آب مقطر حل نموده و حجم را به یک لیتر برسانید. محلول باید در حضور معرف متیل رد با آمونیاک تا پیدایش رنگ زرد خنثی شده باشد.
محلول 0.01 نرمال : EDTA یک عدد تیترازول 0.1 نرمال EDTA را به حجم ده لیتر برسانید. یا 37.224 گرم از نمک (Na2H2Y.2H2O) خالص را که در اون در حرارت 80 درجه سانتیگراد خشک شده است وزن نموده و به حجم ده لیتر برسانید.
محلول بافر : (PH=10) مقدار 50 گرم کلرور آمونیوم را در آب مقطر حل نموده و 550 میلی لیتر NH3 غلیظ اضافه نموده و به حجم یک لیتر برسانید.
کلرور باریم 100 گرم در لیتر : مقدار 100 گرم BaCl2.2H2O را در آب مقطر حل و به حجم یک لیتر برسانید.
محلول نیترات نقره 0.05 نرمال : 8.4938 گرم نیترات نقره را که قبلا در اون در حرارت 105 درجه سانتیگراد حداکثر بمدت یک ساعت قرار داده شده را در آب مقطر حل نموده و حجم را به یک لیتر برسانید. همچنین می توانید یک عدد تیترازول 0.1 نرمال را به حجم 2 لیتر برسانید.

محلول سازی :
محلول سازی یکی از متداولترین و در عین حال دقیق ترین کارهایی است که در آزمایشگاه انجام میشود. محلول سازی به معنای ساختن محلول مورد نظر و لازم از محلولهای استاندارد میباشد.
محلولی را استاندارد می گویند که در آن ، رابطه بین مقادیر ماده حلشده و محلول یا رابطه بین مقدار ماده حلشده و حلال بنحوی معلوم باشد. با معلوم بودن مقدار ماده حلشونده و مقدار حلال تشکیل دهنده محلول ، غلظت محلول مشخص میگردد. بسیاری از واکنشها در حالت محلول انجام میشوند و محاسبههای کمی برای اینگونه واکنشها بر مبنای غلظت آنها صورت میگیرد. برای بیان غلظت ، روشهای گوناگونی وجود دارد و محلولهای استاندارد را براساس غلظت بیان میکند.
محلولهای استاندارد کاربردهای زیادی دارند، از جمله در تجزیه های تیترسنجی (تیتراسیون) ، واکنشهای خنثی شدن و واکنشهای اکسیداسیون-احیا و…
برای محلول سازی باید ابتدا با واحدها و روش های بیان غلظت یک محلول، آشنایی کامل داشته باشید:
ادامه مطلب...
کتاب حاضر در واقع دایره المعارفی است تمام رنگی از تمام ابزار, مواد و دستگاه های آزمایشگاهی مورد استفاده در آزمایشگاه های تشخیص طبی, زیست شناسی, شیمی و حتی فیزیک که تک تک توسط تیم بی بوکس دات آی آر جمع آوری و بصورت یک فایل منسجم منتشر شده است.
این مجموعه ی ارزشمند میتواند مورد استفاده ی تمام رشته های مرتبط با آزمایشگاه قرار گیرد من جمله, رشته های گروه زیست شناسی مثل: ژنتیک, بیوشیمی, سلولی مولکولی, میکروبیولوژی, زیست فناوری یا بیوتکنولوژی, فیزیولوژی جانوری و گیاهی و ... , رشته های گروه شیمی مثل: شیمی آلی, شیمی تجزیه, شیمی دارویی, شیمی معدنی و ... و رشته های گروه های فیزیک.
جهت سهولت کار شما عزیزان, علاوه بر قرار دادن دایره المعارف وسایل آزمایشگاهی بصورت یک فایل یکپارچه 32 مگابایتی برای دانلود در پایین صفحه, در این قسمت به اختصار تمام وسایل آزمایشگاه را بررسی مینماییم تا بتوانید به سرعت نگاهی گذرا به تمام وسایل آزمایشگاه و کارگاهی بیندازید و با آن ها آشنا شوید و در صورت نیاز داشتن اطلاعات اضافی و تکمیلی به همراه عکس فایل ضمیمه را دانلود نمایید.
دانلود درادامه مطلب...
| کروماتوگرافی لایه نازک (TLC) : انواع مختلفى از کروماتوگرافى وجود دارند که در اين ميان TLC از اولين روشهاى کشف شده است. کلاً در تمام روشهاى کروماتوگرافى از يک مادهٔ واسط (Medium) استفاده مىشود که در سطح آن با عبور نمونه، جذب مواد شيميائى صورت مىپذيرد. مواد شيميائى متعددى با شدتهاى متفاوت به اين سطح مىچسبند و بنابراين با سرعتهاى گوناگون از ميان مادهٔ واسط گذر مىکنند. اين تکنيک براى جدا کردن مخلوطى از مواد شيميائى بهکار مىرود و خصوصيات احتباسى(Retention properties) خاص هر يک از آنها وسيلهاى براى تشخيص خواهد بود. |
جزوه دکتر علیرضا بنایی
استاد یار پیام نور اردبیل
۶۶ تصویر با بزرگنمائی های متفاوت. پیشنهاد می کنیم، حتما دانلود کنید.
اندازه فایل: ۶٫۴۱ مگابایت
منبع:پایگاه زیست شناسی پرند
جهت مشاهده آزمایشات علوم پایه(ریاضی،فیزیک،زیست شناسی وزمین شناسی وشیمی) روی هر عنوان کلیک نمایید سپس آزمایش مربوطه را روی کامپیوترخود ذخیره وآن را اجرا نمایید. امیدوارم از این فعالیت نهایت استفاده را برده باشید.
این فایل ها گزارش كار آزمایشگاه شیمی آلی هست. امیدوارم بتونید ازشون استفاده كنید.
من قسمتی از گزارش كار (یعنی روش آزمایش ، نتایج ، خطا ها و خواص فیزیكی مواد) رو گذاشتم.
برای اجرای فایل ها اگر فرمت آنها PDF باشد با نرم افزار Acrobat Reader
میتونید اونها رو اجرا کنید.
اگر احیانا از شما نام کاربری و کلمه عبور میخواست ازینها استفاده کنید
نام کاربری : Shimi33
کلمه عبور : shimi22
- گزارش کار آزمایش تعیین نقطه ذوب دانلود
- گزارش کار آزمایش تقطیر 1 دانلود
- گزارش کار آزمایش تقطیر 2 دانلود
- گزارش کار آزمایش تقطیر بصورت کلی دانلود
- گزارش کار آزمایش تبلور دانلود --- دانلود۲
- گزارش کار آزمایش صابون دانلود
- گزارش کار آزمایش استرفیكاسیون دانلود
- آزمایش كروماتوگرافی
- گزارش کار آزمایش استخراج دانلود
- گزارش کار آزمایش ایزومریزاسیون
- گزارش کار آزمایش تصعید (تبلور مجدد)دانلود
- گزارش کار آزمایش سنتز آسپرین دانلود
- گزارش کار آزمایش ایزومری مالئیک اسید و فوماریک اسید دانلود
-
منبع http://organiclabzmm.blogfa.com/post-17.aspx
هدف :
1_ جدا سازی محصول اصلی یا محصول یا محصولات فرعی در یک واکنش شیمیایی :
در قدیم بهترین روش سنتز (که متنوع نبود ) در فاز مایع بود اما جدیدا در فاز جامد است و نیازمند استخراج است .
در فاز جامد از یک بستر پلیمری استفاده می کنیم ، ماده ای را که می خواهیم به بستر پلیمر متصل شود، به عنوان مثال A را به پلیمر متصل می کنیم بعد B را با آن واکنش می دهیم ، C و D ( محصولات ) چسبیده به پلیمر تشکیل می شوند ، وقتی پلیمر را می شوییم اگر A و B اضافی در محیط باشد خارج می شود ، می توانیم برای شست و شو از حلال های مختلفی استفاده کنیم چون با پلیمر واکنش نمی دهد .(سنتز در فار جامد : برای مواد آلی پیچیده )
و اما ادامه ی مطلب : A و B را که به عنوان واکنش دهنده وارد ترکیب کرده ایم بخشی مواد آلی و بخشی ترکیبات معدنی هستند ، ( فرض : ترکیبات معدنی در آب حل می شوند ) این مجموعه را چند بار شست و شو می دهیم تا فاز آلی و آبی جدا شود به شرطی که از ماده ی اصلی با آب ترکیب نشود که اگر ترکیب شود باید حلالیت را کاهش دهیم ( باید حلالیت ماده ی آلی را در فاز آبی تغییر دهیم یعنی Ksp را کاهش دهیم ، برای آن از نمک ها استفاده می کنند یعنی به جای آب محلول نمک طعام با غلظت بالا تهیه کرده و حل می کنند ، حلالیت ترکیب آلی کاهش یافته رسوب می کند و می توان با صافی جدا کرد ) شرط این که عمل استخراج را با راندمان بالا انجام دهیم این است که حلالیت دومی که بعدا از آب انتخاب می کنیم (با آب اختلاط نشود )
+ صابون در محلول NaCL و آب رسوب می دهد .
استخراج : خارج کردن یک ماده از یک حلال آلی یا آبی و بردن آن به یک حلال آلی یا آبی دیگر و اجازه دهیم که فاز آلی و آبی از هم جدا شوند سپس خدمان آن ها را جدا کنیم و با تبخیر و تقطیر ماده ی مورد نظر را از حلال جدا کنیم .
2_ خالص سازی یک ترکیب آلی و جدا سازی آن از ناخالصی هایش :
حلالی را انتخاب می کنیم که A در آن خوب حل شود و B کمتر، در واقع B یک ناخالصی برای A به حساب آید ، و در حلال دیگر ناخالصی بیشتر حل شود و A کمتر (( به شرطی که این حلال ها باهم اختلاط ندهند )) .اکثر این روش ها به وسیله ی حلال های غیر فعال شیمیایی صورت می گیرد .
حلال غیر فعال شیمیایی : معمولا هیچ واکنشی با مواد انجام نمی دهند و فقط کمک می کنند به حل شدن فیزیکی ماده ی آلی
3_ جدا سازی ترکیبات آلی بوسیله ی حلال های فعال شیمیایی :
این دو ترکیب در آب حل نمی شوند و در حلال آلی مثل اتر حل می شوند .حال تکلیف چیست ؟ از حلال های غیر فعال شیمیایی نمی توانیم برای جداسازی دو ترکیب فوق استفاده کنیم ، بنابر این از حلال های فعال شیمیایی استفاده می کنیم ، باید کاری کنیم که یکی از این ترکیبات در آب حل نشود .
حلال های فعال شیمیایی : اسیدها و باز ها و محلول های نمکی یا نمک ها
بنزیلات سدیم در آب حل می شود ، پس کافی است روی ترکیبات آب بریزیم که مرزی ایجاد خواهد شد، این مرز ها را جدا می کنیم ، آنیلین را جدا کرده و به سراغ بنزیلات سدیم می رویم که ماهیت ترکیب اولیه را عوض کرده ایم و باید بازش گردانیم برای این کار مقداری اسید اضافه می کنیم واکنش بر می گردد و بنزوئیک اسید رسوب می دهد .
آمین های آروماتیک در آب حل نمی شوند ، برای حل کردن آن به محیط اسید HCL اضافه می کنیم ، NH2 با +H حل شده ایجاد می شود ، برای برگشت آنیلین به حالت اولیه ی خودش به محیط -OH اضافه می کنیم .
گاهی اوقات محلول نمکی ماهیت ترکیب را تغییر می دهد و Ksp آن را هم در آب افزایش میدهد .
روش های استخراج : 1_ مایع _ مایع 2_ جامد _ مایع
مایع _ مایع :شکل فیزیکی هر دو ماده مایع است ، حلالی هم که استفاده می کنیم مایع است .
حلالی را انتخاب می کنیم که یکی از مواد مثل A در آن بیشتر حل شود و B کمتر و حلال دیگری برعکس باشد اما اگر هر دو ماده ی A و B در حلال حل شوند عیبی ندارد می شود روش استخراج را عوض کرد یعنی حلالیت یکی را کم کنیم یعنی تغییر حلالیت دهیم .
رزولسینول ها بسیار خورنده هستند و سمی ، در داخل دی اتیل اتر بهتر حل می شود .
جامدی بدست می آوریم که ویسکوزیته ی بالا دارد چون نقطه ی ذوب آن پایین است . به محض این که حرارت دید مقداری جامد شده مجددا مایع می شود که ویسکوزیته ی بالا دارد ، در نهایت یک پودری بدست می آید (( پودر هموژن قهوه ای رنگ )) .
اگر رنگ متفاوت بود بدین معنی است که مقداری از حلال باقی مانده و باید خوب بهم بزنیم تا خارج شود .
طبقه بندی روش های استخراج از نظر تعداد دفعات استخراج :1_ پیوسته 2_ ناپیوسته .
در پیوسته یک بار حجم مشخصی از حلال را بر می داریم و در طول تمامی مراحلاستخراج با همان حجم مشخص کار می کنیم . در ناپیوسته هر بار که می خواهیم عمل استخراج را تکرار کنیم باید یک حجم جدیدی از حلال را بر داریم ،
استخراج پیوسته مقرون به صرفه است .
دستگاه سکسوله : استخراج پیوسته درون آن انجام می گیرد ، استخراج از نوع جامد_مایع
حلال ها: استون ، متانول ، اتانول، و یا مخلوط آب و استون_آب و متانول و آب و اتانول
از این این مخلوط های حلال ها استفاده می کنند چون دمای جوش آب بالا و دمای جوش بقیه پایین است در اثر حرارت دادن ترکیبات آلی آسیب نبینند .
فشار با نقطه ی جوش رابطه ی مستقیم دارد .
خصوصیت حلال های مناسب غیر فعال شیمیایی :
1_ به آسانی قابل جدا کردن باشد 2_ با ماده ی آل واکنش شیمیایی ندهد 3_ سمس و آتش گیر نباشد و ارزان باشد 4_ ماده ی ناخالصی تا حد امکان داخل حلال کمتر حل شود
البته اکثر حلال ها سمی و آتش گیر هستند که برای جبران آن ها از مخلوط حلال ها استفاده می کنیم .
ضریب توزیع :
وقتی می خواهیم ضریب توضیع A را داخل دو حلال 1 و 2 بدست آوریم :
k= غلظت ماده ی A داخل فاز 2 / غلظت ماده ی A داخل فاز 1
K>>1 : یعنی با یک یا دو بار استخراج ماده A را به طور کمی از فاز 1 به فاز 2 می بریم
K<<1 : باید تعداد دفعات استخراج را بیشتر کنیم تا ماده ی A را به طور کمی از فاز 1 به فاز 2 ببریم
تنها عامل فیزیکی که در ضریب توزیع تاثیر می گذارد دما است : دما بیشتر ضریب توزیع بیشتر.
منبع:سایت علمی نخبگان جوان
آلکانها، هیدروکربنهایی هستند که در آنها هر اتم کربن با ۴ پیوند به ۴ اتم هیدروژن یا کربن میچسبند. در واقع پیوند دو یا سه گانه بین اتمهای کربن وجود ندارد. فرمول کلی آلکانها CnH۲n+۲ است. سادهترین آلکان، متان (CH۴) است که بخش عمده گاز طبیعی را تشکیل میدهد. اتان (C۲H۶)، پروپان (C۳H۸) و بوتان (C۴H۱۰) دیگر آلکانهای گازی هستند. پنتان (C۵H۱۲)، هگزان (C۶H۱۴)، هپتان (C۷H۱۶) و اکتان (C۸H۱۸) مهمترین آلکانهای مایع هستند.
نامگذاری آلکانها را موسسه آیوپاک انجام میدهد.
تعداد ایزومرها به ترتیب ۱، ۱. ۱، ۲، ۳، ۵، ۹، ۱۸، ۳۵، ۷۵، ۱۵۹، ۳۵۵،....
تا به حال فرمولی برای تعداد آلکانها پیدا نشده است . فرمول زیر برای آلکانهایی است که دارای ۴ تا ۷ کربن هستند. 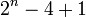
آلکانها میتوانند راست زنجیر یا شاخه دار باشند . مولکولهایی که فرم مولکولی یکسان دارند، اما آرایش اتمها در آنها متفاوت است . هم پاریاایزومر مینامند . آلکانهایی که چهار یا تعداد بیش تری اتم کربن داشته باشند دارای ایزومر هستند . همهٔ آلکانها، گازها، مایعها یا جامدهایی بی رنگ هستند که با افزایش اعداد کربن نقطه جوش و گرانوری(گرانوری یک مایع،میزان عدم تعادل آن رابرای جاری شدن معین می کند) آنها افزایش مییابد . همهٔ آلکانها در هوا با شعله زرد – آبی تمیزی میسوزند .
خواص فیزیکی آلکانها از همان الگوی خواص فیزیکی متان پیروی میکند و با ساختار آلکانها سازگار است. یک مولکول آلکان فقط بهوسیله پیوندهای کووالانسی برپا نگه داشته شدهاست. این پیوندها یا دو اتم از یک نوع را بهم متصل میکنند و در نتیجه، غیر قطبیاند، یا دو اتم را که تفاوت الکترونگاتیوی آنها بسیار کم است، به یکدیگر ربط میدهند و در نتیجه قطبیت آنها کم است. به علاوه، این پیوندها به طریقی بسیار متقارن جهت گرفتهاند، بطوری که این قطبیهای پیوندی نیز یکدیگر را خنثی میکنند.
در نتیجه یک مولکول آلکان یا غیر قطبی است یا قطبیت بسیار ضعیفی دارد. نیروهایی که مولکولهای غیر قطبی را گرد هم نگه میدارند (نیروهای واندروالسی) ضعیف هستند و گستره بسیار محدودی دارند. این نیروها فقط بین بخشهایی از مولکولهای مختلف که با یکدیگر در تماس نزدیک باشند، یعنی بین سطوح مولکولها، عمل میکنند. بنابراین در یک خانوداه معین، انتظار داریم که هر اندازه مولکول بزرگتر و شود در نتیجه سطح تماس آنها بیشتر شود، نیروهای بین مولکولی نیز قویتر میشوند.
دمای جوش و ذوب با افزایش شمار اتمهای کربن، زیاد میشود. فرایند جوشیدن و ذوب شدن، مستلزم فایق آمدن بر نیروهای بین مولکولی در یک مایع و یک جامد است. دمای جوش و دمای ذوب بالا میرود، زیرا این نیروهای بین مولکولی با بزرگ شدن مولکولها افزایش مییابند.
منبع:ویکی پدیا
مقدمه:
واکنش دیلز –آلدر واکنشی است که در آن یک آلکن با یک دی ان مزدوج (۱و۳-دی ان) واکنش می دهد و مشتقی از سیکلو هگزن ایجاد می کند.به آلکن معمولا دی ان دوست یا دی انوفیل می گویند.واکنش اتیلن با بوتا دی ان منجر به تشکیل سیکلو هگزن می شود.
واکنش دیلز – آلدر یکی از مهمترین روش های سنتزی است که در دسترس شیمیدانان آلی است.چنانچه بجای آلکن از یک آلکین استفاده شود مشتقی از ۱ و ۴- سیکلوهگزا دی ان بدست می آید.
واکنش دیلز – آلدر روشی بسیار مناسب برای تشکیل پیوند کربن – کربن و ترکیبات حلقوی شش ضلعی می باشد.در این واکنش پیوندهای کربن –کربن دارای پیوند π در دی انوفیل ازیک طرف و کربنهای ۱ و ۴ – دی ان از طرف دیگر تشکیل می شود بنابراین روی هم رفته دی انوفیل به صورت ۱ و ۴ به دی ان افزایش می یابد.بنابراین پیوندهای دوگانه مزدوج علاوه بر واکنش های معمولی آلکنها مانند افزایش الکترون دوستی در واکنشی دیگر یعنی واکنش دیلز – آلدر نیز شرکت می کنند.این تبدیل که به حلقه افزایی دیلز –آلدر معروف است پیوندهای جدید همزمان و به صورت فضا ویژه تشکیل می شوند. با توجه به اینکه ایجاد کربنهای کایرال امری نه چندان آسان در سنتزهای آلی می باشند، توانایی این واکنش در تشکیل راحت ترکیبات با مراکز نامتقارن اهمیت این دسته از واکنش ها را دو چندان می نماید. از جمله دی انهای مورد استفاده در کاربردهای واکنش دیلز – آلدر ترکیبات حلقوی سولفوردار می باشد. در سالهای اخیر مطالعات زیادی روی ترکیبات حلقوی سولفوردار جهت سنتز ترکیبات مختلف شده است. در این میان ترکیبات حلقوی سولفوردار H 2- تیوپیران -۴- اًُن از اهمیت خاصی برخوردار می باشند. اهمیت این ترکیبات از آنجا ناشی می شود که با استفاده از واکنش دیلز – آلدر این ترکیبات می توان بر محدودیت اساسی واکنش های دیلز – آلدر یعنی واکنش پذیری کم یا عدم واکنش پذیری دی انهای سیس غلبه نمود. دی انهای سیس اغلب هیچ محصول افزایشی در واکنش با دی انوفیلها تولید نمی کنند ولی در عوض دی انهای ترانس هزار برابر فعالتر از دی انهای مشابه سیس می باشند. این عدم واکنش پذیری مربوط به ازدحام فضایی موجود در دی انهای سیس می باشد. یک استراتژی مناسب جهت فائق آمدن بر این مشکل، استفاده ازH 2- تیوپیران -۴- ان می باشد. اولین بار گروه پروفسور Ward و همکارانش از کانادا موفق به انجام واکنش های دیلز – آلدر با استفاده از این ترکیبات به عنوان جانشینان مناسب دی انهای سیس شدند.
این گروه با انجام واکنش دیلز – آلدر بین دی هیدروتیوپیران -۴-ان با دی انوفیلهای خاص و در ادامه سولفورزدایی محصولات، موفق به شناسایی محصولاتی شدند که هم ارز با محصولات دیلز – آلدر حاصل از دی انهای سیس که توانایی شرکت در واکنش دیلز – آلدر را نداشتند، می باشند. با توجه به اهمیت این واکنشها، بر آن شدیم که در این پژوهش به ادامه مطالعات بپردازیم و سنتز ترکیبات جدیدی از این نوع را انجام دهیم.
شرح آزمایش:
در یک بالن تقطیر کاملا خشک حدود ۳ گرم آنتراسن .۲ گرم مالئیک انهایدراید و ۲۰ میلی لیتر تولوئن می ریزیم و ۲ عدد سنگ جوش اضافه کرده ۴۰ دقیقه رلکس می کنیم.پس از خنک شدن محتویات بالن رسوب حاصل را صاف می کنیم بعد از خشک شدن رسوب راندمان را محاسبه می کنیم
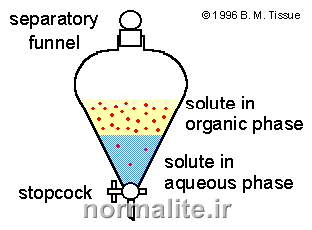
عنوان آزمایش: خالص سازی مواد به روش استخراج
هدف: استخراج آدیپیک اسید از فاز آبی به فاز آلی(اتر)
تئوری آزمایش:
استخراج روشی است برای جداسازی که در آن جسمی از یک فاز به فاز دیگر منتقل می شود. در بعضی مواقع لازم است برای بازیابی یک ماده آلی از راههایی غیر از تقطیر استفاده شود. یکی از این راهها تماس دادن محلول آبی با یک حلال غیر قابل اختلاط با آب است. اگر حلال مناسب باشد، بیشتر مواد آلی(در اینجا آدیپیک اسید) از لایه آبی به حلال آلی (که با آب امتزاج ناپذیر است) انتقال پیدا میکند.
از نظر کمی پخش یک جسم بین دو حلال غیر قابل امتزاج را بر حسب ضریب پخش K بیان میکنند. به عبارت دیگر ضریب پخش(k) یعنی: نسبت غلظت ماده ی حل شده در حلال اول، به غلظت همان ماده در حلال دوم.
حلالی که برای استخراج انتخاب می شود باید دارای این ویژگیها باشد:
1- با حلالی که دارای ماده مورد نظر است،مخلوط نشود.(سیستم دو فازی تشکیل دهد)
2- K ماده در حلال انتخاب شده بزرگ باشد. (یعنی ماده در حلال دوم بیشتر از حلال اول محلول باشد)
3- حلال نباید ما ماده مورد نظر واکنش دهد.
4- حلال انتخاب شده به آسانی تبخیر شود.
5- حلال نباید ناخالصی ها را استخراج کند.
در استخراج مایع-مایع از قیف جدا کننده (دکانتور) استفاده می شود.قیف نباید بیشتر از سه چهارم حجم آن پر شود چون در این صورت امکان هم زدن محلول وجود نخواهد داشت.هدف از تکان دادن و هم زدن این است که سطح تماس دو حلال افزایش یابد و ماده حل شده در حلال اول در مدت زمان کمتری بتواند به حلال دوم برود.(در آن حل شود).هر چند ثانیه یک بار باید قیف را برگرداند(شیر به سمت بالا) و آن را به آرامی باز کرد تا گاز قیف خارج شود.این عمل همیشه باید انجام شود ولی در دو حالت اهمیت بیشتری دارد:
1- وقتی که حلال مورد استفاده دمای جوش پایینی داشته باشد.
2- یک محلول اسیدی با محلولی از سدیم بیکربنات استخراج شود.(در این حالت گاز کربن دی اکسید آزاد می شود)
پس از تکان دادن قیف و خارج کردن گازهای آن، قیف جدا کننده را روی گیره ی حلقه ای قرار می دهند و فرصت می دهند تا فازها به خوبی از هم جدا شوند.
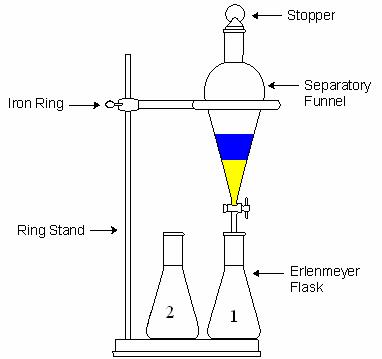
لایه ها طوری جدا می شوند که حلال سنگین تر در پایین قرار می گیرد اما گاهی ممکن است به دلیل حل شدن بیشتر ماده در فاز آلی، حلال آلی پایین تر از آبی قرار بگیرد.برای اطمینان از اینکه کدام فاز آلی و کدام آبی است،در یک بشر کوچک مقداری آب ریخته و سپس با باز کردن شیر قیف جدا کننده چند میلی لیتر از حلال پایینی را به بشری که در آن آب ریخته ایم اضافه می کنیم،اگر دو محلول در یکدیگر حل شوند فاز پایینی آبی است و در غیر اینصورت آلی است.
وسایل و مواد لازم:
آدیپیک اسید، سدیم هیدروکسید، محلول فنل فتالئین، دی اتیل اتر، آب مقطر
قیف جدا کننده، بورت، بشر، همزن، قطره چکان، ارلن،
روش کار:
حلال اول در این ازمایش آب و حلال دوم اتر است.ماده مورد نظر هم آدیپیک اسید می باشد.در این ازمایش میخواهیم آدیپیک اسید را که در آب محلول است،توسط اتر استخراج و به فاز آلی ببریم.
1 گرم آدیپیک اسید را در 100 سی سی آب مقطر حل می کنیم.(همان محلول 1% ).
(از این قسمت می توان غلظت آدیپیک اسید را در فاز آبی حساب کرد.به این صورت که با توجه به وزن آدیپیک اسید و جرم مولکولی آن تعداد مول را حساب کرده و تقسیم بر حجم محلول کنیم.
علاوه بر این می توان بصورت عملی نیز غلظت را در موارد مجهول با استفاده از تیتراسیون با یک محلول باز حساب کرد.)
25 سی سی از این محلول را در قیف جدا کننده می ریزیم و به آن 30 سی سی اتر اضافه می کنیم.عمل استخراج را با توجه به نکات عملی گفته شده انجام می دهیم و سپس مدتی قیف را روی حلقه ساکن می گذاریم تا دو فاز از هم جدا شوند.و هر فاز را بصورت جداگانه داخل ارلن می ریزیم.
در این حالت و پس از انجام عمل استخراج،آدیپیک اسید که در فاز آبی بود به فاز اتری(آلی) منتقل می شود.اما برای اینکه بدانیم چه مقدار از آدیپیک اسید به فاز آلی منتقل شده است، محلول اتری به دست آمده از عمل استخراج را،با محلول سدیم هیدروکسید تیتر می کنیم.
M1 مولاریته اسید در فاز آلی
V1 حجم فاز آلی
M2 مولاریته محلول سدیم هیدروکسید ( این محلول را خودمان تهیه می کنیم پس مقدار مولاریته ی آن را می توانیم با توجه به جرمی از سود که در مقدار مشخصی آب حل کرده ایم حساب کنیم)
V2 حجم محلول سدیم هیدروکسید مصرف شده (در تیتراسیون)
(چون آدیپیک اسید یک اسید دو عاملی است حتماً باید موقع محاسبه غلظت بعد از انجام تیتراسیون ضریب دو را نیز در فرمول فوق واردکنیم.)
به این ترتیب می توان مولاریته اسید در فاز آلی یعنی M1 را بدست آورد.و به این ترتیب متوجه می شویم که چه مقدار از اسید از فاز آبی به فاز آلی منتقل شده است.و در این حالت K به آسانی قابل محاسبه خواهد بود.
مثلاً اگر مولاریته با انجام تیتراسیون 0.5 مولار بدست اید.در این حالت K به این صورت خواهد بود:
مفهوم این عدد این است که ماده مورد نظر در حلال دوم(اتر) 2.77 برابر حلال اول(آب) حل می شود.
در پایان می توان به این سوالات پاسخ داد:
1- وزن اسید در لایه ی اتری و آبی چقدر است؟
راهنمایی: مولاریته اسید در هر دو فاز را بدست آوردیم.برای به دست آوردن وزن اسید در هر لایه کافیست به حجم برداشته شده از دو حلال دقت کنیم. یعنی با داشتن مولاریته و حجم به راحتی تعداد مول را بدست آورده و تعدا مول را با استفاده از جرم مولکولی اسید،به وزن(جرم) تبدیل کنیم.
2- درصد اسید در لایه ی اتری و آبی چقدر است؟
راهنمایی: پس از بدست اوردن جواب سوال اول، می توان درصد وزنی وزنی را نیز حساب کرد. مثلا اگر وزن ترکیب در 25 سی سی 2 گرم باشد،بدیهی است که در صد سی سی 8 خواهد بود(8درصد)
3- بازده استخراج چقدر است؟
راهنمایی: در حالت ایده آل (یعنی بازده 100%) باید کل اسید از فاز آبی به آلی منتقل شود که مطمئناً این گونه نیست.و مقداری از اسید در آب باقی خواهد ماند.بازده را در اینجا می توان برحسب غلظت یا وزن حساب کرد.(که جوابها یکی است)
بازده= مقدار استخراج شده ی اسید تقسیم بر مقدار اولیه اسید
4- غلظت کل اسید داده شده در مجهول اولیه چقدر بوده است؟
غلظت اولیه اسید در بالا در متن روش کار حساب شد. و یا می توانستیم از طریق تیتراسیون محاسبه کنیم.
5- K را محاسبه کنید.
مقدار فرضی k در بالا حساب شد. به همان روش می توان مقدار k را در آزمایش حساب کرد.
در پایان آزمایش باید نتیجه گیری و منابع خطا ذکر شود.
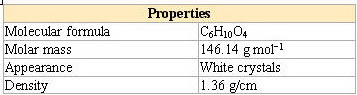
* جدول خصوصیات آدیپیک اسید جهت اطلاع بیشتر:
تعداد صفحات : 54 صفحه
فرمت گزارش : PDF
معمولا نوشتن و به نگارش درآوردن چیزهایی که مشاهده میکنیم کمی مشکل است.
در آزمایشگاه باید تمام حواس به نحوه و روش آزمایش باشد و وقت کمی برای یادداشت برداری وجود دارد.
گزارش آزمایشگاه شیمی آلی شامل تئوری،شرح،آنالیز داده ها،جداول و نمودارها،عکس و ... از آزمایشات است.
این گزارش آزمایشگاه شامل تئوری،شرح،آنالیز داده ها،جداول و نمودارها،عکس و ... نه آزمایش میباشد که عبارتند از:
» آزمايش تعيين نقطه ذوب
» آزمايش تقطير 1
» آزمايش تقطير 2
» آزمايش تبلور
» آزمايش صابون
» آزمایش آسپرین
» آزمايش استرفيكاسيون
» آزمايش استخراج
» آزمايش ايزومريزاسيون
»» بخشهایی از این گزارش آزمایش:
شیمی آلی زیر مجموعه ای از دانش شیمی است که درباره ترکیبات کربن یا مواد آلی سخن می گوید، عنصر اصلی که با کربن ترکیبات آلی را تشکیل می دهند، هیدروژن می باشد. در گذشته به موادی که ریشه گیاهی یا حیوانی داشتند، مواد آلی می گفتند اما امروزه مواد آلی را می توان از طریق روش های صنعتی و آزمایشگاهی و به کمک مواد معدنی نیز سنتز کرد. موادی که از منابع آلی بدست می آیند، در یک ویژگی مشترک هستند و آن اشتراک در دارا بودن عنصر کربن است. دو منبع بزرگ مواد آلی که از آنها مواد آلی با ترکیبات ساده، تأمین می شوند، نفت و زغال سنگ هستند، این دو ماده فسیلی در مفهوم قدیمی آلی بوده و حاصل تجزیه جانوران و گیاهان هستند. این ترکیبات ساده به عنوان مصالح ساختمانی، در ساختن ترکیبات بزرگتر و پیچیده تر مصرف می گردند. شیمی آلی، شیمی ترکیبات کربن با سایر عناصر به ویژه هیدروژن، اکسیژن، نیتروژن، هالوژن ها و غیر فلزات دیگر نظیر گوگرد و منیزیوم است. الکل ها، اترها، هیدروکربن ها، آلدئیدها، کتون ها، کربوکسیلیک اسیدها، ترکیبات آلیفاتیک حلقوی، کربانیون ها، آمین ها، فنل ها، درشت مولکول ها و بسپارها (پلیمر) و نظیر آنها جزء مواد آلی بوده و مباحث شیمی آلی را به خود اختصاص داده اند. امروزه از مواد آلی و دانش شیمی آلی در رنگ سازی، کاغذ و جوهرسازی، مواد غذایی، پوشاک، پتروشیمی، مواد پلاستیکی و لاستیکی، داروسازی، پزشکی و ده ها صنعت دیگر بهره می برند. افزون بر بیست میلیون ترکیب شناخته شده کربن وجود دارد و هر ساله نیم میلیون ملکول جدید به خانواده مواد آلی اضافه می شوند. شیمی آلی شالوده زیست شناسی و پزشکی است. ساختمان موجودات زنده به غیر از آب، عمدتا" از مواد آلی ساخته شده اند، مولکول های مورد بحث در زیست شناسی مولکولی همان مولکول های آلی هستند. امروزه ما در عصر کربن زندگی می کنیم، هر روزه روزنامه ها و مجلات، ذهن ما را متوجه ترکیبات کربن نظیر کلسترول، چربی های اشباع نشده، هورمون ها، استروئیدها، حشره کش ها و فرومون ها می نماید. در دهه های گذشته به خاطر نفت جنگ های متعددی راه افتاده است، همچنین دو فاجعه نازک شدن لایه اوزون که عمدتا" به خاطر وجود کلرو فلوئورو کربن ها می باشد و پدیده گازهای گلخانه ای که ناشی از حضور متان، کلرو فلوئورو کربن ها و دی اکسید کربن است، زندگی انسان ها را به خطر انداخته است.
تقطیر نوبتی
هدف :
1_ جدا کردن ترکیبات آلی مایع که اختلاف اختلاف نقطه ی جوش آن ها خیلی کم باشد، حتی دو درجه
2_ برای جدا کردن مخلوط هایی که با هم تشکیل مخلوط ایده آل را بدهند (آزوتروپ نداشته باشند)
3_ ترکیبات آلی مایع شکل را با خلوص بیشتری تهیه کنیم.
در این آزمایش ستون تقطیر ویگروز مورد استفاده قرار می گیرد .
کارایی ستون تقطیر دربالا بردن راندمان تقطیر :
1_ طول ستون تقطیر ، هر چه طول بیشتر کارایی هم بیشتر یا به عبارتی تقطیر هم بهتر صورت می گیرد ( رابطه ی مستقیم دارد )
2_ ساختار داخلی ستون تقطیر
3_ جنس ، (هدایت گرمایی ) اگر به جای شیشه فلز ( آلیاژ) باشد بهتر است چون فلزات در مقابل شیشه هدایت گرمایی بهتری دارند ، به همان میزان که هدایت گرمایی بالا رود کارایی افزایش پیدا می کند
4_ افزایش سطح تماس مایع و بخار باعث افزایش کارایی می شود
5 طول ستون فرضی : کاهش ستون فرضی باعث افزایش کارایی می شود،
با افزایش تعداد تشکک های فرضی به شرطی که طول ستون ثابت باشد راندمان تقطیر افزایش میابد
مثال: اگر مخلوطی از A و B داشته باشیم که :
دما ......تعداد تشکک ها....... اندازه ی ستون
100 ............2 .......................1m
30_50 ........5 .......................1m
15_20 .......10 ......................1m
5_10 ........50 ......................1m
2_5 ........100 ......................1m
عواملی که در راندمان تقطیر تاثیر می گزارد :
1_ سرعت تقطیر (پایین باشد بهتر است )
2_ اعمال حرارت به آهستگی صورت گیرد ، اگر دما ار بالاتر ببریم می توانیم از نقطه ی جوش ماده ی فرار تر به نقطه ی جوش ماده ی کم فرار تر برسیم و نتوانیم ماده ی اول را با خلوص کم از بقیه جدا کنیم
3_ مقدار مایع برگشتی به داخل بالن تقطیر باید کمتر از مقدار مایع تقطیر شده باشد ، اگر این گونه نباشد یعنی حرارت زیاد است .
4_ مقدار مایع جمع شده در خاتمه ی تقطیر نوبتی در داخل تشتک های فرضی ، هر چه مایع کمتر جمع شده باشد نشان دهنده ی این است که راندمان تقطیر بهتر است .


عواملی که در اندازه گیری تاثیر می گزارد : 1_ اعمال حرارت با سرعت زیاد ( حرارت باید آهسته باشد ) 2_ استفاده از سنگ جوش : چون تشکیل بخارات به سرعت اتفاق می افتد 3_ اندازه گیری سرعت تقطیر _ تعداد قطرات )
آنچه از سایت های دیگر در رابطه با موضوع تقطیر نوبتی گلچین شده است :
تقطیر نوبتی
این نوع تقطیرها در قدیم بسیار متداول بوده، ولی امروزه بعلت نیاز نیروی انسانی و ضرورت ظرفیت زیاد ، این روش کمتر مورد توجه قرار میگیرد. امروزه تقطیر نوبتی ، صرفا درصنایع دارویی و رنگ و مواد آرایشی و موارد مشابه بکار برده میشود و در صنایع پالایش نفت در موارد محدودی مورد استفاده قرار میگیرد. بنابراین در موارد زیر ، تقطیر نوبتی از نظر اقتصادی قابل توجه میباشد.
*تقطیر در مقیاس کم
*ضرورت تغییرات زیاد در شرایط خوراک و محصولات مورد نیاز
*استفاده نامنظم از دستگاه
*تفکیک چند محصولی
*عملیات تولید متوالی با فرآیندهای مختلف
وقتی ماده ناشناخته است مهمترین کار: تعیین ثابت های فیزیکی (خصوصیت های فیزیکی) ترکیب آلی است ؛ مهمترین ثابت های فیزیکی عبارتند از :
رنگ ماده، بو، شکل بلور ها، نقطه ی ذوب، نقطه ی جوش، نقطه ی تصعید، ضریب انکسار نور، طیفIR ، طیف NMR، طیفUV، طیف سنجی جرمی، آنالیز عنصری .
در اثر وجود ناخالصی رنگ بلور ها تغییر می کند ، شکل بلور ها هم این گونه است .
نقطه ی ذوب: دمای نقطه ای را به ما می دهد که در آن از فاز جامد به مایع می رویم به شرطی که در انتقال از جامد به مایع در فشار استاندارد محیط با 1 اتمسفر صورت بگیرد .
تعریف دوم و صحیح تر : عبارت از دمایی است که در آن دما فاز جامد و مایع به حالت تعادل می رسد .

قابل توجه است که رطوبت نیز مانند ناخالصی عمل کرده و در خصوصیت های فیزیکی ماده تغییر ایجاد می کند .
ناخالصی ها دو ماهیت دارند که یا محلول اند یا نامحلول، ناخالصی محلول روی نقطه ی ذوب تاثیر منفی خواهد داشت چون میزان محلول را زیاد می کند در صورتی که اگر ناخالصی نامحلول باشد با افزایش دما نمی تواند وارد فاز مایع شود بنابر این هیچ تاثیری نمی گذارد.
مثال :سولفات کلسیم در نقطه ی ذوب استانلید تاثیر نمی گذارد،
کلرور سدیم در فاز مایع است و در نقطهی ذوب استانلید تاثیر می گذارد .
بنابراین: آن موادی به عنوان ناخالصی محلول عمل می کنند که یک خاصیت یونیزاسیون در آن ها وجود داشته باشد.
رطوبت تاثیر منفی می گذارد .
برای یک ماده ی خالص حداکثر اختلاف دمایی که بین Tm1 و Tm2 خواهیم دید بین 0.5 تا 1 درجه خواهد بود اما برای ماده ای که ناخالصی دارد این اختلاف دما بین 5 تا 10 درجه می تواند باشد و هر چه ناخالصی بیشتر باشد اختلاف دما بین نقطه ی ذوب ابتدایی و انتهایی بیشتر خواهد بود .
نحوه ی تشخیص نقطه ی ذوب: اگر ماده جمع شود ( کم شود ) و یا گاهی شبنم مانند هایی در محلول ایجاد می شود که همیشه نشان دهنده ی نقطه ی ذئب ابتدایی است ، اگر محلول شفاف شد به نقطه ی ذوب نهایی رسیده ایم و همه ی جامد ها به مایع تبدیل شده است .
اندازه گیری نقطه ی ذوب مخلوط چند ماده :
فرض کنید دو ماده داریم :A با نقطه ی ذئب 118 درجه و B با نقطه ی ذوب 90 درجه وقتی آنها را با هم مخلوط می کنیم دو امکان وجود دارد:1_ تشکیل مخلوط اتکتیک می دهند : نقطه ی ذوب حاصل خیلی پایین تر از مواد اولیه است مثلا 60 درجه 2_ تشکیل مخلوط اتکتیک نمی دهند : در این صورت B به صورت ناخالصی روی A عمل می کند و نقطه ی ذوب A را حداکثر 20 درجه کم میکند مثلا مخلوط حاصل دارای نقطه ی ذوبی برابر 108 درجه خواهد شد .
شاخصه ی نقطه ی اتکتیک این است که نقطه ی ذوب مخلوط حاصل بسیار پایین تر از نقطه ی ذوب مواد اولیه است

نکته : در این نقطه فاز جامد A و B را داریم که با مایع های خود در تعادل اند(شباهتی با نقطه ی ذوب دارد) .
از نقطه ی اتکتیک در صنعت برای تهیه ی آلیاژ های مختلف استفاده می شود بدین صورت که دو فلز را ذوب می کنند و اگر آن دو به یک نقطه ی اتکتیک رسیدند بنابر این می توان از آن ها آلیاژ تهیه کرد
آلیاژها: ترکیبی از چند فلز با نسبت های مختلف که در تهیه ی آن ها از نقطه ی اتکتیک استفاده می شود
نقطه ی اتکتیک فقط در مورد فلزات نیست در بعضی مواقع مواد آلی در کنار آب (رطوبت ) نقطه ی اتکتیک تشکیل داده و نقطه ی ذوب بسیار پایین خواهد آمد .
اندازه گیری نقطه ی ذوب در آزمایشگاه ها با استفاده از لوله ی مویین است .
سوالات مطرح :
چه عواملی در نقطه ی ذوب تاثیر می گذارد ؟ شکل بلور ها ، اندازه ی بلور ها، مقدار بلور ها، فشرده بودن بلور ها .
چرا در نزدیکی Tm1 باید دما را کنترل کنیم ؟ باید کنترل کنیم تا بتوانیم نقطه ی ذوب را اندازه گیری کنیم
نقطه ی اتکتیک چه ویژگی هایی دارد؟ در بالا توضیح داده شد .
کروماتوگرافی آنی (سریع یا لحظه ای ) با ستون خشک
دید کلی
کروماتوگرافی ستونی یکی از مهمترین روشهاتی جداسازی ترکیبات در آزمایشگاههای سنتز مواد است. متاسفانه این روش در آزمایشگاههای آموزشی کمتر استفاده میشود. زیرا مدرسان باید بین نسخه ناقص ، کروماتوگرافی ستونی ثقلی و فنون جدید نظیر کروماتوگرافی آنی و کروماتوگرافی با فشار متوسط که نیاز به لوازم شیشهای مخصوص و گرانقیمت و ستونهای مخاطره انگیز دارد، یکی را انتخاب کنند.
روش ساده دیگری که کمتر شناخته شده است، کروماتوگرافی آنی با ستون خشک است. این روش همان قدرت جداسازی روشهای پیشرفته را داراست، ولی به صورت قابل ملاحظهای کمخطر و ارزانتر از آنهاست. همچنین یادگیری و استفاده از آن آسان است. از آنجا که کروماتوگرافی آنی با ستون خشک در هیچ یک از متنهای آزمایشگاهی مقدماتی توضیح داده نشده است، در اینجا سازگاری این روش را برای آزمایشگاهی آموزشی شرح دهیم.
روش کار کروماتوگرافی آنی با ستون خشک
روش کار عمومی روش کروماتوگرافی آنی با ستون در انباشتن ستون ، نشاندن نمونه و شستشوی ستون شبیه انواع کروماتوگرافی است. به هر حال این ستون شامل ستون شبیه انواع دیگر کروماتوگرافیهاست. به هر حال ، این ستون شامل یک بستر خشک از سیلیکاژل در یک قیف شیشهای متخلخل است که با استفاده از مکش شویش و پس از هر جزء ستون خشک میشود.
این ویژگیها باعث میشود تا ستون ، راحتتر انباشته شود و لازم نیست دانشجویان ، نگران پایین آمدن سطح حلال از سطح سیلیکاژل باشند. در نتیجه استفاده کنندگان تازهکار ، بدون مشکل خاصی نتایج رضات بخشی بدست میآورند و بهآسانی جداسازیهایی انجام میدهند که قابل مقایسه با نتایج جداسازی با کروماتوگرافی لایه نازک است.
وسایل کار کروماتوگرافی آنی با ستون خشک
ستون شامل سیلیکاژل (مرک با نمره 60) است که درون قیف شیشهای متخلخل با قطر 4cm و با خلل و فرج متوسط انباشته میشود. بقیه دستگاه ، شامل چندین لوله آزمایش میلیمتری و شیشهآلات صافی خلاء استاندارد است. حلال شویش ، مخلوطی از حلال قطبی و حلال ناقطبی است، (مثلا میتوان از هگزان و اتیل استات استفاده کرد.) مزیت این دو حلال در این است که فشار بخار مشابهی دارند و در ضمن در همه آزمایشگاهها میتوان را بازیابی کرد.
انباشتن ستون
قیف تا لبه با سیلیکاژل فشرده می شود (25 تا 30 گرم). در مرحله بعد با ضربات آهسته ای که به قیف زده میشود، گرد سیلیکاژل نشست کرده ، فضاهای خالی پر میشود. سپس مکش انجام میگیرد. مرحله نهایی ، انباشتن شامل فشردن محکم با یک میله شیشهای تهصاف ، همزمان با بکارگیری مکش است. در نهایت ، انباشتن باید طوری انجام گیرد که سطح بستر متراکم شده ، حدود 1سانتیمتر با لبه قیف فاصله داشته باشد، (اگر ضروری باشد مقداری از سیلیکاژل برداشته شود تا فضای لازم ایجاد شود). لازم نیست که سطح ستون حتما بصورت کاملا صاف در آید.
آزمون ستون
به منظور اطمینان از عدم وجود شیارها و فضاهای خالی در ستون ، بدقت روی بستر هگزان ریخته میشود و همزمان با بکارگیری مکش ، آزمون صورت میگیرد. سطح بستر تا زمانی که حلال (هگزان) شروع به خروج از انتهای قیف کند، باید پوشیده از حلال باشد. سپس افزایش هگزان قطع میشود و ستون تا خشک شدن کامل تحت مکش قرار میگیرد. اگر انباشتن ستون درست انجام گرفته باشد، جبهه هگزان در یک خط افقی نزول خواهد کرد و در نهایت ، بستر خشک به صورت یک دست و بدون ترک در خواهد آمد.br>
اگر هگزان در یک طرف بسیار سریعتر پایین بیاید یا اگر شیارها و فضاها در سطح بستر گسترش پیدا کند، در این صورت ستون با مکش کاملا خشک و بار دیگر از ابتدا انباشته میشود و دوباره آزمون صورت میگیرد.
محافظت از ستون
تشکیل یک گودی کوچک در وسط در طی افزایش حلال ، اجتناب ناپذیر است. با این حال میتوان با گذاشتن کاغذ صافی و افزایش حلال روی این کاغذ ، تا حدی از ستون محافظت کرد.
نشاندن نمونه مخلوط
ساده ترین راه برای قرار دادن نمونه در ستون ، حل کردن نمونه در حجم اندکی از هگزان است (400mg از نمونه در 2 تا 3 میلی لیتر هگزان حل میشود). محلول را به آرامی در ستون بریزید و سپس مکش را بکارگیرید. برای نمونههایی که در هگزان حل نمیشوند، میتوان از مخلوط هگزان- اتیل استات استفاده کرد. نمونه با 3 تا 4 حجم از هگزان مخلوط و اتیل استات قطره قطره افزوده میشود تا نمونه حل شود و محلول بدست آمده همانند مورد قبل به ستون افزوده میشود (بهتر است ستون را با دو یا سه ستون هگزان پیش از شروع مرحله شویش شستشو داد).
راه دیگر برای نشاندن نمونههای نامحلول در هگزان ، جذب شدن آن نمونه در مقداری از سیلیکاژل تازه است. این کار بدین ترتیب انجام میگیرد که نمونه را در حلال قطبی حل کرده ، 5 هم ارز جرمی از سیلیکاژل میافزاییم تا ماده خمیر مانندی بدست آید و سپس حلال را تبخیر میکنیم. ژل خشک به صورت یکنواخت در قسمت بالای ستون گسترانده میشود.
شویش ستون
به محض آنکه نمونه روی ستون نشانده شد با استنفاده از مخلوطهای هگزان و اتیل استات که قطبیت آن به تدریج افزوده میشود، شویش ستون شروع میشود. معمولا دانشجویان ، جزءهای حلال را مستقیما در لوله های آزمایش میلیمتری که در درون ارلن گذاشته میشود جمع آوری میکنند. بنابراین مجبور نیستید هر بار ، ارلن بشویند (صرفه جویی در حلال) و در ضمن ، خطر تداخل و آلودگی اجزای نمونه با یکدیگر حذف میشود.
شویش با استفاده از یک مکش قوی و ریختن 25 میلیلیتر از حلال شستشو بهصورت آرام (بخش محافظت از ستون را ببینید) انجام میگیرد. به محض اینکه ستون کم و بیش خشک شد یا لوله آزمایش پر شد، مکش متوقف و لوله آزمایش برداشته میشود. اغلب مقداری از حلال از طریق تبخیر یا جذب کم میشود. بنابراین استفاده از مقادیر کم حلال برای افزودن به ستون عاقلانه نیست.
قطبیت حلال شستشو باید آهسته ، اما پیوسته و یکنواخت از یک جزء به جزء دیگر افزایش یابد. به عنوان نمونه ، میتوان برای اولین حلال از هگزان استفاده کرد. سپس پیوسته مقدار اتیل استات را در جزء بعدی حدود 1 تا 2 درصد افزایش داد تا مخلوط ، شستشو یابد (افزایش بیشتر غلظت با مخلوطهای سادهتری نظیر فروسن و استیل فروسن امکان پذیر است).
مخلوط کردن اجزای حلال ، قسمت بزرگی از وقت تلف شده این روش را در بر میگیرد، اما با بکارگیری روش چهار مرحلهای زیر ، زمان مورد نیاز را بصورت قابل ملاحظهای کوتاه میکند.
مرحله 1 :صد میلیلیتر از مخلوط حلال که برای جزء X لازم است، در ظرف 100 میلیلیتری مدرج شده تهیه و 25 میلی لیتر از آن برای جزء X مصرف میشود.
مرحله 2 :یک قسمت کوچک از اتیل استات (0,5 الی 1 میلیلیتر) به باقیمانده حلال افزوده میشود و 25 میلیلیتر از این مخلوط برای جزء X+1 استفاده میشود.
مرحله 3 و 4 :همان عملیات مرحله 2 برای اجزای X+3 و X+2 تکرار میشود.
حال به مرحله اول برمیگردیم و یک مخلوط قطبیتر از X+3 درست میکنیم.
تشخیص نمونه
اگر اجزای نمونه رنگی باشد (فروسن و استیل فروسن) ، پیشرفت جداسازی با چشم دیده میشود. به هر حال ، روش بسیار متداول جمع آوری 12 تا 16 نمونه و شناسایی همزمان آنها با TLC است.
کاربردها
این روش با موفقیت برای مخلوطهای در گستره 150 میلیگرم تا یک گرم بکار برده شده است، به شرط اینکه قطبیت حلال به تدریج افزوده شود. قدرت جداسازی ، همانند TLC خواهد بود. جداسازیها میتوانند شامل فروسن و استیل فروسن ، سیس و ترانس ، 3،3،5- تری متیل سیکلو هگزانول (که از کاهش کتون با NaBH4 بدست آمده است) و جداسازی مخلوط مجهول دوتایی غیر رنگی (یکی از اجزای پروپیوفنون - اتیل بنزوآت - آنتول و جزء دیگر ارتو دیاتیل فتالات - ارتو دی متیلا فتالات با سینامیل الکل است) باشد.
در هر کدام از موارد بالا ، جداسازی کامل با موفقیت انجام میگیرد، بویژه جداسازی دیاسترومرهای سیکلوهگزال جالب است، زیرا NaBH4 واکنشگری با دیاستریوگزینی متوسط است و دانشجویان با استفاده از NMR میتوانند بین دو دیاستومر تفاوت قائل شوند. اگر چه در توصیف محدودیتهای این روش ، امکان تخریب اکسایشی وجود دارد، ولی ما این مورد را حتی درباره آنتول و سینامیل الکل مشاهده نکردیم.
مطالب سایت نرمالیته ( شیمی کاربردی دانشگاه گلستان )
تولید تولوئن ( گزارش کار شیمی آلی )
تولید تولوئن
تهیه یکی از مشتقات بنزن از گروه آرماتیکها
تئوری آزمایش تولید تولوئن
آروماتیکها ، دسته وسیعی از ترکیبات که شامل بنزن و ترکیباتی میباشند که از نظر رفتار شیمیایی ، مشابه بنزن میباشند. برخی از این مواد حتی به ظاهر شباهتی به بنزن ندارند. برخلاف آلکنها و آلکینها ، بنزن و سایر ترکیبات آروماتیک تمایلی برای انجام واکنشهای افزایشی از خود نشان نمیدهند، ولی در واکنشهای جانشینی شرکت میکنند که یکی از صفات شاخص این دسته از مواد میباشد.
تولوئن ، مایعی است بیرنگ با نقطه انجماد 95.1- درجه سانتیگراد و جوش 110.6درجه سانتیگراد و در ساختار دماسنجهای دمای پایین بکار میرود. همینطور تولوئن ، حلال خوبی در شیمی آلی بشمار میرود.
در این آزمایش ، میخواهیم تولوئن را به روش آزمایشگاهی تهیه کنیم.
وسایل مورد نیاز
لوله آزمایش بزرگ
چراغ
کاغذ تورنسل
بنزن
یدید متیل (CH3I)
آلومینیوم کلراید (AlCl3) پودری شکل
شرح آزمایش تولید تولوئن
در داخل یک لوله آزمایش بزرگ و مقاوم ، 2ml از مایع بنزن را با چند قطره از یدید متیل ( CH3I ) و 0.4 گرم آلومینیوم کلراید (AlCl3 ) پودری شکل به آرامی حرارت دهید تا هنگامی که کاغذ تورنسل مرطوب شده در بالای لوله آزمایش ، از رنگ آبی به سرخ تبدیل شده و پایان واکنش را مشخص نماید.
نتیجه آزمایش
واکنش صورت گرفته به صورت زیر است:
C6H6 + CH3I (+AlCl3 + Heat ) → HI + C6H5CH3
این ، یک واکنش جانشینی الکترونخواهی از نوع واکنشهای فریدل- کرافت است. این واکنش ، نشان میدهد که بنزن ، تمایلی برای انجام واکنشهای افزایشی ندارد و با حفظ هر سه پیوند دو گانه خود ، در واکنش جانشینی شرکت میکند.
سوالات
در مورد واکنشهای فریدل- کرافت چه میدانید؟
فکر میکنید علت اینکه بنزن تمایلی به شرکت در واکشنهای افزایشی ندارد، چیست؟
آیا میدانید نقش AlCl3 در آزمایش فوق چیست؟
تولید ( تهیه ) گاز متان
هدف آزمایش تولید گاز متان
تهیه کوچکترین و مهمترین هیدروکربن زنجیری سیرشده یعنی متان CH4
تئوری آزمایش تولید گاز متان
متان ، گازی است بیرنگ ، بیبو و در آب نامحلول که نقطه ذوب آن -182درجه سانتیگراد و نقطه جوش آن 162-درجه سانتیگراد است. متان از گروه هیدروکربنهای سیر شده زنجیری یا آلکانها میباشد که فرمول عمومی آنها CnH2n+2 میباشد. گاز طبیعی که در منازل وجود دارد و مورد استفاده قرار میگیرد، مخلوطی از هیدروکربنهای زنجیری سیر شده است که %95 از آن ، گاز متان است و در اثر ترکیب با گاز اکسیژن ، تولید گاز دیاکسید کربن و بخار آب و حرارت میکند.
مخلوطی از یک حجم از گاز متان و ده حجم از هوا در اثر جرقه ، تولید انفجار بسیار شدید مینماید که انفجار معادن زغال سنگ از آن ناشی میشود.
میخواهیم گاز متان را به صورت آزمایشگاهی تهیه کنیم.
وسایل مورد نیاز
کپسول چینی
هاون
ترازو
مثلث نسوز
لوله آزمایش بزرگ و مقاوم
چاقو
پنس یا انبر فلزی
گیره و پایه فلزی
سدیم استات (CH3COONa , 3H2O)
آهک زنده (CaO)
سود جامد (NaOH جامد)
شرح آزمایش تولید گاز متان
10 گرم سدیم استات متبلور را در یک کپسول چینی و روی مثلث نسوز حرارت دهید تا ذوب شده و آب تبلور را از دست بدهد. چراغ گاز را خاموش و پس از سرد شدن کپسول محتویات ، داخل آن را با نوک چاقو تراشیده و در یک هاون چینی همراه 3 گرم آهک زنده و 3 گرم سود جامد ، نرم کوبیده تا به صورت پودر در آید. مخلوط را در داخل یک لوله آزمایش بزرگ و مقاوم که دهانه آن را با در لاستیکی که از آن ، لوله باریک شیشهای عبور داده شده است بستهاید، حرارت دهید.
در اثر حرارت ، مخلوط ذوب گردیده و پس از آن به مدت یک دقیقه همچنان عمل حرارت دادن را ادامه دهید تا هوای لوله کاملا خارج گردد و پس از آن ، گاز را مشتعل و سوختن گاز متان را مشاهده نمایید.
نتیجه آزمایش
واکنش تولید گاز متان در این آزمایش طبق واکنش زیر است:
CH3COONa + NaOH → Na2CO3 + CH4
از مخلوط آهک با سدیم هیدروکسید ، تولید آهک سُده (آهک سود دار) میشود که جاذب گازهایی نظیر CO2 ، SO2 است و به جای سدیم هیدروکسید در تهیه بسیاری از واکنشها مثلا تهیه متان بکار میرود. گاز متان امروزه در زندگی بشر جایگاه بسیار مهمی دارد و در زندگی روزمره با این ماده حیاتی استفاده نماید.
سوالات
فکر میکنید علت استفاده از آهک سُده به جای سود در چنین واکنشهایی چیست؟
آیا کاربردهایی از متان در صنعت میشناسید؟
این روش تهیه گاز متان ، یک روش آزمایشگاهی است. میدانید در صنعت این گاز چگونه تولید میشود که مقرون به صرفه باشد؟
هدف آزمایش تولید گاز استیلن
تهیه کوچکترین عضو خانواده آلکینها و بررسی اثر بر شناساگر مخصوص (محلول نیترات نقره آمونیاکی)
تئوری آزمایش تولید گاز استیلن
هر گاه ترکیب آلی ، دارای پیوند سهگانه کربن به کربن باشد، آلکین نامیده میشود. استیلن با فرمول C2H2 ، کوچکترین عضو این خانواده میباشد و به همین دلیل ، آلکینها را ترکیبات استیلنی یا استیلنهای استخلافدار گویند.
آلکینها ، ترکیباتی با قطبیت کمتر میباشند که در حلالهای با قطبیت کمتر مثل تتراکلرید کربن ، بنزن و اترها بخوبی حل میشوند، ولی در آب نامحلولند. همانند سایر هیدروکربنها سبکتر از آب هستند.
فرمول عمومی آلکینها CnH2n-2 میباشد. در این آزمایش ، میخواهیم گاز استیلن را در آزمایشگاه تولید کنیم.
وسایل ومواد مورد نیاز تولید گاز استیلن
بالن تقطیر 100ml
قیف شیردار
بطری شستشوی گاز
گیره و پایه فلزی
کلسیم کربید CaC2
سولفات مس II اسیدی شده با اسید سولفوریک
محلول نیترات نقره آمونیاکی
لوله آزمایش
شرح آزمایش تولید استیلن
ابتدا باید توجه داشته باشید که این آزمایش ، نباید در معرض شعله چراغ گاز باشد. یعنی مواد اولیه آزمایش را جهت تولید گاز استیلن حرارت نمیدهیم. در داخل بالن تقطیر ، قطعات کوچکی از کلسیم کربید ریخته و روی آن ، قیف شیردار دارای آب قرار دهید. لوله خروجی بالن تقطیر را به بطری شستشوی دارای محلول سولفات مس II اسیدی شده با اسید سولفوریک جهت جذب ناخالصیهای گاز وصل کنید تا گاز ایجاد شده از آن عبور کند و ناخالصیهای آن گرفته شود.
سپس میتوانید گاز ایجاد شده را به داخل هر ظرفی که خواستید هدایت و آن را جمع آوری کنید و یا به داخل ظروف مختلفی جهت بررسی واکنشهای آن با مواد مختلف هدایت کنید. به عنوان مثال ، لوله خروجی از بطری شستشوی گاز را به داخل لوله آزمایش حاوی محلول نیترات نقره آمونیاکی هدایت کنید. اثر گاز بر آن ، سبب تولید رسوب سفید رنگ استیلید نقره میشود که با یک مولکول آب متبلور میگردد. (این رسوب را دور بریزید).
نتیجه آزمایش
واکنشی که تحت آن ، گاز استیلن تولید میشود، از این قرار است:
CaC2 + 2H2O → Ca(OH)2 + CH≡CH
اثر گاز استیلن بر شناساگر مخصوص آن ، یعنی نیترات نقره آمونیاکی به این صورت است:(شناساگر نیترات نقره آمونیاکی را میتوان به صورت محلول اکسید نقره آمونیاکی یا Ag2O نشان داد)
C2H2 + Ag2O → Ag2C2 + H2O
Ag2C2 ، رسوب سفید رنگ استیلید نقره است.
گاز استیلن در صنعت جوشکاری کاربرد دارد.
سوالات
آیا میدانید واکنش سوختن کامل استیلن با اکسیژن خالص را بنویسید؟
واکنش پذیری آلکینها در مقایسه با آلکنها (با توجه به تئوری آزمایش) چگونه است؟
عنوان آزمایش : تعیین نقطه جوش به روش میکرو
هدف
تعين نقطه جوش يك مايع توسط مايه ديگر با دماي جوش بالا
مقدمه :
تئوري
نقطه جوش یک مایع :
نقطه جوش یک مایع به صورت درجه حرارتی تعریف میشود که در آن فشار بخار مایع برابر با فشار بیرونی باشد. چنانچه فشار خارج 760 میلیمتر جیوه باشد. یک مایع وقتی خواهد جوشید که فشار بخار آن برابر با این مقدار باشد. برای مثال آب وقتی از دمای 100Cْ خواهد جوشید که فشار خارجی و فشار بخار آن برابر با 760 مییلیمتر جیوه باشد. در فشار 526 میلیمتر جیوه آب در 90Cْ میجوشد و اگر فشار را به 9.2 میلیمتر برسانیم نقطه جوش آب در 10Cْ خواهد بود به این علت است که نقطه جوش آب در ارتفاعات کمتر از مناطق نزدیک به سطح دریا میباشد.
فشار بخار
مولکولهای یک مایع دارای انرژی جنبشی هستند و انرژی جنبشی مولکول معینی از یک مایع ضمن برخورد با سایر مولکولها دائما تغییر میکند. در یک لحظه معین تعدادی از مولکولها دارای انرژی نسبتا زیاد و تعدادی دارای انرژی نسبتا کمی هستند مولکولهایی که انرژی جنبشی آنها زیاد است میتوانند بر نیروی جاذبه مولکولهای اطراف خود غلبه کرده و از سطح مایع فرار کرده و وارد فاز گاز میشوند.
اگر مایع در حال تبخیر در یک ظرف سربستهای محبوس باشد مولکولهای بخار نمیتوانند از نزدیکی مایع دور شوند و تعدادی از مولکولهای بخار به فاز مایع بر میگردند سرانجام حالتی پیش میآید که در آن سرعت فرار مولکولها از فاز مایع به بخار (تبخیر) و سرعت برگشت مولکول از فاز بخار به مایع (میعان) برابر میشود. فشار بخاری که در دمای معین با مایع خود در حال تعادل است، فشار بخار نامیده میشود.
چگونگی جوشیدن یک مایع
وقتی که فشار بخار یک مایع با فشار جو برابر می شود، مایع شروع به جوشیدن میکند. در این دما ، بخار حاصل در داخل مایع سبب ایجاد حباب و غلیان خاص جوشش میشود. تشکیل حباب در دمای پایینتر از نقطه جوش غیر ممکن است، زیرا فشار جو بر سطح مایع که بیش از فشار داخل آن است، مانع از تشکیل حباب میشود. دمای مایع در حال جوش تا هنگامی که تمام مایع بخار نشده است، ثابت میماند در یک ظرف بدون درپوش حداکثر فشار بخاری که هر مایع میتواند داشته باشد برابر با فشار جو میباشد.
فشار بخار هر مایع تنها از روی دما معین میشود. بنابراین اگر فشار بخار ثابت باشد دما نیز ثابت است. برای ثابت ماندن دمای یک مایع در حال جوش باید به آن گرما داده شود. زیرا در فرایند جوش مولکولهای با انرژی زیاد از مایع خارج میشوند. اگر سرعت افزایش گرما بیش از حداقل لازم برای ثابت نگهداشتن دمای مایع در حال جوش باشد، سرعت جوشش زیاد میشود ولی دمای مایع بالا نمی رود.
تاثیر فشار در نقطه جوش
نقطه جوش یک مایع با تغییر فشار خارجی تغییر میکند. نقطه جوش نرمال یک مایع ، دمایی است که در آن فشار بخار مایع برابر با یک اتمسفر باشد. نقطه جوش داده شده در کتابهای مرجع ، نقاط جوش نرمال میباشند. نقطه جوش یک مایع را میتوان از منحنی فشار بخار آن بدست آورد و آن دمایی است که در آن فشار بخار مایع با فشار وارد بر سطح آن برابری میکند.
وسايل مورد نياز:
1-دماسنج
2-لوله مويين
4-شعله
5-پارافین
6-تیل
7- پايه
شرح آزمايش
اندازه گیری نقطه جوش به روش میکرو:
یک لوله مویین را گرفته و آن را از به دو قسمت نا مساوی شکسته ( 2 به 1 ) و بعد دو سر آن را روی شعله حرارت داده تا از یک سمت بسته شوند و بعد دو قسمت بسته شده را گرم کرده و دوباره به هم متصل می کنیم . هدف از این کار ایجاد یک گره در لوله مو یین بوده . حالا مجهول خود را درون لوله آزمایش میریزیم (تقریبا 1.5 تا 2 سانتیمتر) و لوله مویین را از سمتی که به گره نزدیکتر است درون لوله آزمایش حاوی مجهول می اندازیم . حال دماسنج را به وسیله ی حلقه ی پلاستیکی یا چسب نواری به قسمت فوقانی لوله آزمایش متصل می کنیم . حال لوله آزمایش را درون تیل حاوی پارافین قرار می دهیم و چراغ بنزن را روشن کرده و تا دمای پارافین و به همراه آن مجهول ما بالا برود . در هنگام بالا رفتن دما ابتدا چند حباب به صورت مجزا و با تاخیر از زیر لوله معین خارج می شود وقتی که حباب ها به صورت پیوسته شورع به خارج شدن از انتهای پایینی لوله معین کردن چراغ بنزن را خاموش کرده و منتظر کاهش دما میشویم تا وقتی که خروج حباب ها متوقف شود و مجهول ما از لوله مویین بالا برود . دما در این لحظه دمای جوش مایه مورد نظر می باشد . در توضيح اين فرايند بايد گفت كه در طول عمل گرم كردن اوليه،هواي موجود درون لوله ي مويين منبسط ميشود و در صورت افزايش فشار بخار مايع به مقدار كافي ،مايع شروع به جوشيدن ميكند،كه بر اثر ان هواي لوله مويين به صورت حبابهاي منظم از ان خارج ميشود به محض اين كه گرما قطع كنيم فشار بخار مايع پايين مي ايد به طوري كه به تدريج از فشار هوا كمتر ميشود و دقيقا در همين مرحله مقداري از مايع به درون لوله مويين كشيده مي شود .
خطاها در آزمایش :
دراندازه گیری نقطه جوش به روش میکرو به مشكلاتي از قبيل زير پيش مي آيد
1-چون مقدار مايع اندك است در صورت افزايش ناگهاني گرمااحتمال بخار شدن آن زياد است ويا اين كه نقطه جوش بدست آمده بيشتر از مقدار واقعي باشد
2-اگر گرم كردن كافي نباشد در نزديكي نقطه جوش در صورت گرما ممكن است مايع از لوله ي آزمايش وارد لوله مويين شود.زيرا در اين لحظه فشار بخارمايع پايين تر از فشار هوا است.
نقطه ي جوش بدست آمده در اين روش به علت تجربه پايين آزمايش كننده وخطاي چشم ، تقريبي،و غالبا كمتر از مقدار واقعي است
انواع روش های تقطیر
دید کلی
در اینجا ، منظور از تقطیر ، در واقع جداسازی فیزیکی برشهای نفتی در پالایشگاه است که اساس آن اختلاف در نقطه جوش هیدروکربنهای مختلف است. هر چه هیدروکربن ، سنگینتر باشد، نقطه جوش آن زیاد است و هر چه هیدروکربن سبکتر باشد، زودتر خارج میشود. در این مقاله انواع روشهای تقطیر را در برج تقطیر بررسی میکنیم.
تقطیر تبخیر ناگهانی
در این نوع تقطیر ، مخلوطی از مواد نفتی که قبلا در مبدلهای حرارتی و یا کوره گرم شدهاند، بطور مداوم به ظرف تقطیر وارد میشوند و تحت شرایط ثابت ، مقداری از آنها به صورت ناگهانی تبخیر میشوند. بخارات حاصله بعد از میعان و مایع باقیمانده در پایین برج بعد از سرد شدن به صورت محصولات تقطیر جمع آوری میشوند. در این نوع تقطیر ، خلوص محصولات چندان زیاد نیست.
تقطیر با مایع برگشتی (تقطیر همراه با تصفیه)
در این روش تقطیر ، قسمتی از بخارات حاصله در بالای برج ، بعد از میعان به صورت محصول خارج شده و قسمت زیادی به داخل برج برگردانده میشود. این مایع به مایع برگشتی موسوم است. مایع برگشتی با بخارات در حال صعود در تماس قرار داده میشود تا انتقال ماده و انتقال حرارت ، صورت گیرد. از آنجا که مایعات در داخل برج در نقطه جوش خود هستند، لذا در هر تماس مقداری از بخار ، تبدیل به مایع و قسمتی از مایع نیز تبدیل به بخار میشود.
نتیجه نهایی مجوعه این تماسها ، بخاری اشباع از هیدروکربنهای با نقطه جوش کم و مایعی اشباع از مواد نفتی با نقطه جوش زیاد میباشد.در تقطیر با مایع برگشتی با استفاده از تماس بخار و مایع ، میتوان محصولات مورد نیاز را با هر درجه خلوص تولید کرد، مشروط بر اینکه به مقدار کافی مایع برگشتی و سینی در برج موجود باشد. بوسیله مایع برگشتی یا تعداد سینیهای داخل برج میتوانیم درجه خلوص را تغییر دهیم. لازم به توضیح است که ازدیاد مقدار مایع برگشتی باعث افزایش میزان سوخت خواهد شد. چون تمام مایع برگشتی باید دوباره به صورت بخار تبدیل شود.
امروزه به علت گرانی سوخت ، سعی میشود برای بدست آوردن خلوص بیشتر محصولات ، به جای ازدیاد مایع برگشتی از سینیهای بیشتری در برجهای تقطیر استفاده شود. زیاد شدن مایع برگشتی موجب زیاد شدن انرژی میشود. برای همین ، تعداد سینیها را افزایش میدهند. در ابتدا مایع برگشتی را 100درصد انتخاب کرده و بعد مرتبا این درصد را کم میکنند و به صورت محصول خارج میکنند تا به این ترتیب دستگاه تنظیم شود.
انواع مایع برگشتی
مایع برگشتی سرد: این نوع مایع برگشتی با درجه حرارتی کمتر از دمای بالای برج تقطیر برگردانده میشود. مقدار گرمای گرفته شده ، برابر با مجموع گرمای نهان و گرمای مخصوص مورد نیاز برای رساندن دمای مایع به دمای بالای برج است.
مایع برگشتی گرم: مایع برگشتی گرم با درجه حرارتی برابر با دمای بخارات خروجی برج مورد استفاده قرار میگیرد.
مایع برگشتی داخلی: مجموع تمام مایعهای برگشتی داخل برج را که از سینیهای بالا تا پایین در حرکت است، مایع برگشتی داخلی گویند. مایع برگشتی داخلی و گرم فقط قادر به جذب گرمای نهان میباشد. چون اصولا طبق تعریف اختلاف دمایی بین بخارات و مایعات در حال تماس وجود ندارد.
مایع برگشت دورانی: این نوع مایع برگشتی ، تبخیر نمیشود. بلکه فقط گرمای مخصوص معادل با اختلاف دمای حاصل از دوران خود را از برج خارج میکند. این مایع برگشتی با دمای زیاد از برج خارج شده و بعد از سرد شدن با درجه حرارتی کمتر به برج برمیگردد. معمولا این نوع مایع برگشتی در قسمتهای میانی یا درونی برج بکار گرفته میشود و مایع برگشتی جانبی هم خوانده میشود. اثر عمده این روش ، تقلیل حجم بخارات موجود در برج است.
نسبت مایع برگشتی
نسبت حجم مایع برگشتی به داخلی و محصول بالایی برج را نسبت مایع برگشتی گویند. از آنجا که محاسبه مایع برگشتی داخلی نیاز به محاسبات دقیق دارد، لذا در پالایشگاهها ، عملا نسبت مایع برگشتی بالای برج به محصول بالایی را به عنوان نسبت مایع برگشتی بکار میبرند.
تقطیر نوبتی
این نوع تقطیرها در قدیم بسیار متداول بوده، ولی امروزه بعلت نیاز نیروی انسانی و ضرورت ظرفیت زیاد ، این روش کمتر مورد توجه قرار میگیرد. امروزه تقطیر نوبتی ، صرفا در صنایع دارویی و رنگ و مواد آرایشی و موارد مشابه بکار برده میشود و در صنایع پالایش نفت در موارد محدودی مورد استفاده قرار میگیرد. بنابراین در موارد زیر ، تقطیر نوبتی از نظر اقتصادی قابل توجه میباشد.
تقطیر در مقیاس کم
ضرورت تغییرات زیاد در شرایط خوراک و محصولات مورد نیاز
استفاده نامنظم از دستگاه
تفکیک چند محصولی
عملیات تولید متوالی با فرآیندهای مختلف
تقطیر مداوم
امروزه بعلت اقتصادی بودن مداوم در تمام عملیات پالایش نفت از این روش استفاده میشود. در تقطیر مداوم برای یک نوع خوراک مشخص و برشهای تعیین شده شرایط عملیاتی ثابت بکار گرفته میشود. بعلت ثابت بودن شرایط عملیاتی در مقایسه با تقطیر نوبتی به مراقبت و نیروی انسانی کمتری احتیاج است. با استفاده از تقطیر مداوم در پالایشگاهها مواد زیر تولید میشود:
گاز اتان و متان بعنوان سوخت پالایشگاه ، گاز پروپان و بوتان بعنوان گاز مایع و خوراک واحدهای پتروشیمی ، بنزین موتور و نفتهای سنگین بعنوان خوراک واحدهای تبدیل کاتالیستی برای تهیه بنزین با درجه آروماتیسیته بالاتر ، حلالها ، نفت سفید ، سوخت جت سبک و سنگین ، نفت گاز ، خوراک واحدهای هیدروکراکینگ و واحدهای روغن سازی ، نفت کوره و انواع آسفالتها.
منبع:http://ichem.ir
تئوری آزمایش
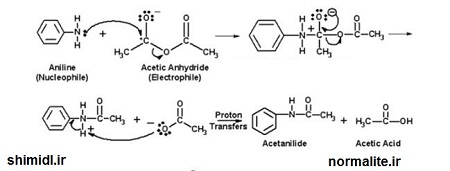
آمین های استیل دار شده آروماتیک به عنوان مسکن درد اهمیت ویژه ای دارند و در زمره داروهایی که بدون نسخه پزشک خریداری و مورد استفاده قرار می گیرند. استانیلید ، فناستین و استامینوفن مسکن های ملایم و کاهش دهنده تب می باشند.
استانیلید خالص سمی است و از راه پوست به بدن صدمه می زند. از استانیلید در تهیه داروها و رنگها و همچنین به عنوان تثبیت کننده به محلول آب اکسیژنه استفاده می شود.
استانیلید یا همانN -فنیل استامید دارای فرمول C6H5NHCOCH3 بوده و جزء دسته آمین های نوع دوم است. با وجود آنکه از این ماده در تهیه داروها استفاده می شود.
مصرف زیاد یا طولانی استانیلید سبب بیماری خونی بنام مت هموگلوبینمیا می شود. در این بیماری ، اتم آهن مرکزی هموگلوبین از حالت آهن(II) به حالت آهن(III) تبدیل می شود و مت هموگلوبین می دهد. مت هموگلوبین نمی تواند حمل اکسیژن را در خون انجام دهد و نتیجه آن نوعی کم خونی است که با کاهش هموگلوبین یا از دست رفتن سلول های قرمز همراه است.
از واکنش آمین با اسید انیدرید ، آمید تشکیل می شود. استیل دار شدن آمین از راه های متفاوتی انجام می شود که عبارتند از واکنش آمین با استیک انیدرید ، استیل کلرید و یا استیک اسید گلاسیال. استفاده از استیک انیدرید برای سنتز آزمایشگاهی ارجحیت دارد. زیرا خلوص محصول و بازده آن مناسب است.
سنتز استانیلید از آنیلین
استیل دار کردن آنیلین با استفاده از استیک انیدرید در محیط اسیدی به سادگی و با راندمان نسبتا خوبی امکانپذیر است. عامل استیله کننده در این آزمایش استیک انیدرید میباشد
آنیلین
انواع آنیلین
۱) تجاری
۲) خالص شیمیایی
کاربرد و مصارف
۱) بطور وسیع در ساخت رنگهای نساجی و مواد میانی رنگهای نساجی استفاده می شود.
۲) در صنایع لاستیک سازی ، از مشتقات آنیلین به عنوان تسریع کننده و تقویت و استحکام لاستیک و ضد اکسید شدن استفاده می شود.
۳) در صنایع داروسازی ، آنیلین در ساخت داروهای سولفانیل آمید و عوامل شیرین کننده سنتتیک مصرف می شود.
۴) آنیلین همچنین در صنایع انفجاری از اهمیت خاصی برخوردار است و در ساخت ژلاتین و نیتروتولوئن استفاده می شود.
خصوصیات آنیلین
۱) آنیلین ماده ای است که سریعاً در مجاورت هوا و نور قهوه ای رنگ می شود.
۲) وزن مولکولی آنیلین ۱۲/۹۳ می باشد.
۳) نقطه ذوب آنیلین ۲/۶ درجه سانتیگراد است.
۴) نقطه جوش آنیلین ۴/۱۸۴ درجه سانتیگراد است.
۵) وزن مخصوص آن ۰۲۳۶/۱ است.
۶) محلول در الکل و اتر است.در آب حلالیت اندکی دارد.
روش تولید آنیلین
چندین روش ساخت آنیلین وجود دارد که عبارتند از:
۱) از نیتروبنزن بوسیله احیاء
۲) از کلروبنزن بوسیله آمونولیز
۳)از نیتروبنزن بوسیله هیدروژن دارکردن کاتالیستی فاز بخار
استانیلید
استانیلید یا فنیل استامید نرمال یا استانیلین نرمال یک ماده ورقه ای (پرکی شکل) سفید یا کرم رنگ می باشد. این ماده در انواع بی رنگ، کریستالی براق نیز موجود است. از این ماده به عنوان تب بر و ضد درد استفاده می گردد. همچنین استانیلید به عنوان یک ماده میانی در ساخت رنگینه ها نقش حیاتی ایفا می کند.
خصوصیات
۱) استانیلید یک پودر سفید رنگ یا کرم رنگ یا به صورت ورقه ای می باشد.
۲) وزن مولکولی آن برابر ۱۶/۱۳۵ می باشد.
۳) وزن مخصوص استانیلید ۲۱/۱ می باشد.
۴) نقطه ذوب آن ۲/۱۱۴ درجه سانتیگراد می باشد.
۵) نقطه جوش استانیلید ۸/۳۰۳ درجه سانتیگراد می باشد.
۶) در الکل، اتر و بنزن حلالیت دارد.
۷) حلالیت آن در آب ناچیز است.
کاربرد و موارد مصرف
استانیلید به گسترده به عنوان تب بر و ضد درد استفاده می شود. مصرف اصلی استانیلید به قرار زیر می باشد.
۱) داروئی
۲) مواد میانی و ساخت رنگهای نساجی
۳) به عنوان تسریع کننده در صنایع لاستیک سازی
۴) پایدار کننده پراسید
انواع
۱) صنعتی
۲) فوق العاده خالص
بررسی جایگاه صنعتی
در حال حاضر بین ۸ تا ۱۰ سازنده استانیلید در کشور هندوستان وجود دارد که مجموع ظرفیت آنها بالغ بر ۲۸۵۰ تن می باشد. هر چند تولیدات آنها بالغ بر ۲۱۰۰۰ تن می باشد ولی میزان تقاضای آن حدود ۳۲۰۰ تن تخمین زده می شود.
روش تولید
دو روش عمده جهت تولید استانیلید وجود دارد.
۱) از آنیلین و اسید استیک
فرمول واکنش : (بازده ۹۰ درصد)
آب استانیلید اسید استیک آنیلین
۲) از آنیلین و انیدرید استیک
فرمول واکنش:
آب استانیلید انیدرید استیک آنیلین
اگر یک گروه OH به استانیلید اضافه شود استامینوفن تولید می شود
|
نام: |
استیک انیدرید Acetic anhydride |
|
نام دیگر: |
استیل اکسید Acetyl oxide |
|
فرمول مولکولی: |
C4H6O3 |
|
جرم مولکولی (گرم بر مول): |
۱۰۲٫۰۹ |
|
نقطه ذوب (درجه سانتیگراد): |
-۷۳ |
|
چگالی (گرم بر سانتیمتر مکعب): |
۱٫۰۸ |
|
حالت: |
مایع |
|
رنگ: |
بدون رنگ |
|
pH: |
~3 |
|
خطرات: |
آتشگیر، مضر، خورنده |
|
نام: |
آنیلین Aniline |
|
نام دیگر: |
آمینوبنزن Aminobenzene
فنیل آمین Phenylamine |
|
شکل مولکول: |
در بالا ذکر شده |
|
فرمول مولکولی: |
C6H7N |
|
جرم مولکولی (گرم بر مول): |
۹۳٫۱۳ |
|
نقطه ذوب (درجه سانتیگراد): |
-۶٫۲ |
|
درجه احتراق (درجه سانتیگراد): |
~۱۹۰ |
|
چگالی (گرم بر سانتیمتر مکعب): |
۱٫۰۲ |
|
حالت: |
مایع |
|
رنگ: |
بدون رنگ |
|
pH: |
~8.8 |
|
خطرات: |
سمی، خطرناک برای محیط |
ابزار و مواد لازم:
پیست آب مقطر-ارلن-استوانه مدرج-پیپت-چراغ بونزن-ترازو-کاغذ صافی-قیف شیشه ای
آنیلین-استیک انیدرید
شرح آزمایش:
ابتدا ۲ccآنلین را درون یک ارلن ریختیم و به آن ۱۵ccآب اضافه می کرنیم.بهم می زنیم وبه محتویات ارلن۲٫۵cc هم استیک انیدرید اضافه کردیم
مخلوط را به شدت هم می زنیمتا رسوبت کرم رنگی تشکیل شود.
حال ۴۰ml آب به محتویات ارلن اضافه می کنیم وروی شعله ملایم حرارت می دهیم تا محلول شفافی به دست آید. درون محلول زغال سیاه می ریزیم وبعد روی شعله قرار می دهیم
شعله را قطع کرده و صبر می کنیم تا محلول در هوای آزاد خنک شود و کریستال هایی درون ارلن تشکیل شود.کریستال ها را توسط کاغذ صافی از محلول جدا می کنیم و می گزاریم تا کاملا خشک شود.
حال استانیلید به دست آمده را به کمک ترازو وزن می کنیم و در آخر می توانیم راندمان را نیز محاسبه کنیم.
| d | M | |
|
آنیلین |
۱٫۰۳۹ | ۹۳٫۱۳ |
|
استیک انیدرید |
۱٫۰۸ | ۱۰۳٫۹ |
محاسبات:
وزن کاغذ صافی: ۱٫۰۶gr
وزن رسوب و کاغذ صافی:۳٫۸۸gr
وزن رسوب: ۲٫۸۲ gr
d= mآنیلین=d.v mآنیلین =۱٫۰۳۹×۱۰-۳ d= mاستیک انیدرید=d.v mاستیک انیدرید= ۱٫۰۸×۱۰-۳ تعداد مولهای آنیلین=۱٫۰۲×۱۰-۳g× ۱٫۰۹۵×۱۰-۵ mol تعداد مولهای استیک انیدرید=۱٫۰۸×۱۰-۳g× =۱٫۰۳۹×۱۰-۵ mol مقدار گرمهای تولید شده=۱٫۰۳۹×۱۰-۵ mol× =۱٫۴۰×۱۰-۳ گرم تجربی/گرم تئوری=
نتیجه گیری:
با نحوه تولید استانیلید که یک داروی شیمیایی و یکی از ارکان تولید استامینوفن است آشنا شدیم.
موارد خطا:
اگر زیاد حرارت دهیم روغین تیره رنگی ایجاد میشود که این همان خطای آزمایش است.
مقدمه و تئوری : در مورد آسپیرین، بازگو کردن داستان آن، بهعنوان نمونهای از تکامل مناسبات بین طب گیاهی سنتی و داروشناسی جدید، بیفایده نیست.منشا این دارو را باید در پوست درخت بید جستجو کرد، که درختی از خانواده salix است و معمولاً در مناطق پرآب میروید. و تنها هنگامی واقعا شاداب است که پایه آن در آب باشد. بنابر نظریه عوام، این بهمعنای آن است که بید سرما نمیخورد، و بههمین دلیل باید به کار درمان سرماخوردگیهای همراه با تب، دردهای مفصلی، و ناراحتیهای مشابه بخورد.
و از آنجا که این، پوست درخت بید است که آنرا در بر گرفته و گرم نگه میدارد پس خاصیت مورد نظر را باید در پوست بید جستجو کرد. در قرن هجدهم، متوجه شدند که پوست بید، از لحاظ تلخی شبیه به پوست درختی در پرو به نام «سینکونا» است که از آن گنهگنه میگرفتند و این دارو عالیترین وسیله درمان بیماری تبآور مالاریا به حساب میآمد. بهاین ترتیب، جوشانده پوست بید را برای درمان تب مورد استفاده قرار دادند. در سال ۱۸۲۹ ، «لرو» از فرانسه، موفق شد از پوست بید مادهای به دست آورد که خود، آن را «سالیسین» (مشتق از اسم لاتینی این درخت) نامید. دیری نگذشت که داروسازی سوئیسی به نام«پاگن ستشر» از راه تقطیر گل اسپیره کوهی (که گیاهی است از خانواده spiraea و آن هم دوست دارد که پایهاش درون آب باشد) مادهیی به دست آورد با نام شیمیایی «سالیسیلات متیل» که بسیار شبیه به سالیسین بود. دنباله این ماجرا به آلمان میکشد که درآنجا، چند سال بعد، ماده مشابه دیگری به نام «اسید سالیسیلیک» برای نخستین بار بهطور مصنوعی تهیه شد. از این ماده نیز مشتق دیگری به نام«اسید استیل سالیسیلیک» به دست آمد که (ضمن اینکه کلمه salix که همان بید باشد در اسم آن انعکاس یافته) چیزی نیست جز اسم رسمی آسپیرین که داروی رایج ضد درد است و هجای «spir» در آن، یادآور منشا گیاهی دیگر آن، یعنی اسپیره کوهی است.جریانات مشابه این، منجر به پیدایش تعداد زیادی از داروهای جدید شده است که منشا آنها را باید در گیاهانی که از دیرباز بر بشر شناخته شده بودهاند جستجو کرد. بهعنوان مثال، «افدرین» که در معالجه آسم به کار میرود از علف «افدرا» به دست میآید، که دست کم از ۵ هزار سال پیش در طب چین مورد استفاده است. نام گیاهان ضد درد پرقدرتی چون سیکران، مهرگیاه، تریاک و انقوزه، در قدیمیترین رسالههای داروسازی بابل و سومر آمده است.در واقع، قابلیت برطرف کردن درد، شاید نخستین پیروزی بزرگ طب بود که خیلی پیشتر از قابلیت طب به درمان بیماریها پدید آمد. در مصر باستان داروهای مسکن وجود داشت، و در «تب» در حدود سال ۱۶۰۰ (ق.م) رساله طبی نگاشته شد که حاوی فهرستی بود از هفتصد گیاه، از آن جمله گیاهان ملین مثل سنا و کرچک، و گیاهانی از قبیل گیاهان خانواده seilla که در ناراحتیهای قلبی مورد استفادهاند. این، طب یونان بود که تحت تاثیر طبیبانی چون بقرات و دیوسکورید، ارزشدرمان کنندگی گیاهان طبی را ـجدا از اهمیتی که این گیاهان از لحاظ شعائر و سحر و جادو، برای انسانهای گذشته داشتندـ تثبیت کرد. اما پس از سقوط امپراطوری روم، سحر و جادو مجدداً مسلط شد، و شناخت و مطالعه گیاهان طبی مامن خود را در دیرها و صومعهها حست و دانش پزشکی به دست محققان عرب شکوفا شد. ما اکنون میدانیم که برخی عارضههایی که در آثار محققان قرون وسطی ذکر شده ـمانند نوعی التهاب پوستی که به «آتش سنآنتوان» موسوم استـ ناشی از قارچِ ریزی است که به جان غلات میافتد و وقتی عده زیادی از مردم، نان حاصل از این غله آلوده را میخورند به مسمومیت دستهجمعی و نیز وهمزدگی ـکه در قرون وسطی آن را ناشی از عمل شیطان میدانستندـ دچار میشوند. اما تا قرن هجدهم ـارجوت که همان قارچ مورد بحث باشدـ شناخته نشد. جالب است بدانیم که امروزه ارجوت را در تهیه تعداد زیادی از داروهای مخصوص معالجه فشار خون و اختلالات خونی دیگر، مورد استفاده قرار میدهند.کشف امریکا توسط سیاحان اروپایی و پیدا شدن راه دریایی به هندوستان، انواع جدیدی از گیاهان را بر آنچه که از دوران باستان شناخته شده بود افزود و باعث غنای هر چه بیشتر فهرست عظیم گیاهانی شد که در طب جدید مورد استفادهاند. قرن نوزدهم، نشانگر فصل جدیدی در شیوه استفاده از گیاهان طبی و به منزله دوره گذرا از شیوه استفاده از گیاهان یا معجونهای حاصل از آنها برای مصارف درمانی، به شیوه استفاده از مولکولهای فعال موجود در آنهاست. این در واقع دورهای است که طی آن، جهانبینی زایای جوامع نوپای صنعتی، آغاز به واژگون کردن تصور سنتی از طبیعت میکند. اکنون دیگر طبیعت در نظر آنها چیزی نیست، مگر منبع عظیمی از مواد خام سهلالوصول. منابع طبیعی برای بهرهبرداری ساخته شدهاند و انسان جدید در واقع گاهی بیش از اندازه از آنها بهرهبرداری میکند. دنیای گیاهان که زمانی مرکب از «شخصیتها»ی فردی گیاهان بود، اکنون تنها به منزله معدنی تلقی میشود که تنها وظیفه آن قراردادن مواد خود در اختیار انسان است. با این همه باید گفت که در بسیاری از موارد، این تلقی جدید نسبت به گیاهان مزایایی دارد. مثلاً وقتیکه میتوان از چغندر، ابتدا قند تهیه کرد و سپس به مصرف رساند، هیچکس حتی فکر آن را هم نمیکند که برای شیرین کردن چای خود، تکهای چغندر در آن بیندازد!با پیشرفتن این جریان، زمانی میرسد که شیمیدانان یک ماده فعال معین را مصنوعاً تهیه میکنند، و در آن هنگام دیگر به گیاهی که این ماده را در اصل از آن تهیه میکردند نیازی نیست. در مرحله بعدی، یعنی زمانی که از یک محصول مصنوعی، یک رشته مشتقات گرفته شد و پس از آزمایش به روی حیوانات، به فهرست دایمالتزاید داروهای شیمیایی افزوده میشود، آنگاه دیگر هیچکس به خاطر نمیآورد که روزی روزگاری گیاهی بود، که همین اثرات درمانی را ایجاد میکرد. چه کسی امروز به خاطر میآورد که «آمفتامین»ها که به عنوان محرک در درمان افسردگی مورد استفادهاند، صرفاً اعقاب مصنوعی مادهای طبیعی هستند که از گیاه «افدرا» به دست میآمد؟به این ترتیب قفسه داروخانههای امروز، پر است از محصولات مصنوعی که سرمنشا بسیاری از آنها را باید در موارد موجود در گیاهان طبی جست. انسان به صورتی دمافزون مولکولهایی مصنوعی ایجاد میکند که در دنیای طبیعت نظیری ندارد. و سپس از این مولکولها موادی را برای مصارف درمانی تهیه میکند. این ترکیبات مصنوعی که هر روز به مقدار بیشتر و بیشتری و برای مصارف گوناگون تهیه میشوند، باعث ایجاد پدیدهای میگردند که میتوان آن را «آلودگی دارویی» نامید. با عوارض جدی ناشی از مصرف روزانه مقدار فراوانی دارو توسط مردمی که فیالواقع بیمار نیستند: داروهای محرک، داروهای مسکن، انواع داروهای اعصاب، قرصهای ضد حاملگی و غیره. تمام این داروهای آرامبخش که به مقدار فراوان مورد مصرف تعداد زیادی از افرادِ اساساً تندرست قرار میگیرند، که به اعتقاد خود، با مصرف این داروها وضع و حالشان بهتر میشود. واین جز خیالی باطل نیست، چراکه هیچ تضمینی نیست که اثر این داروها، در درازمدت به نفع شخص باشد.این است که عده زیادی از خود میپرسند که اگر توسعه افسارگسیخته صنعتیِ مبتنی بر تولید و مصرف مقادیر دمافزونی از کالاها ادامه پیدا کند، چه پیشخواهد آمد؟اکنون بسیاری خواهان آنند که پژوهشهایی در زمینه ابداع شیوههای درمانی ملایمتر و نرمتر که برای بدن انسان عوارض کمتری داشته باشد انجام گیرد و همراه با آن، تولید و مصرف گیاهان طبی در سطح جهان افزایش چشمگیر یابد. اما پیش از بریدن از افراطکاریهای تمدن شیمیزدهمان و ابداع یا احیای روشهای درمانیایی که مناسبات انسان و محیط زیستش را بر پایه بهتری قرار دهد، معقول آن است که یک بار برای همیشه، رابطه بین پزشکی علمی و طب سنتی اطبا و حکیمان را روشن سازیم. چراکه این شبیه رابطه زن و شوهری است که از زندگی با یکدیگر خسته شدهاند، اما در عین حال توانایی تنها زیستن را ندارند! آنچه به سرعت لازم است انجام گیرد، آشتی بین این دو است. و این چیزی است که در پژوهشی که از سوی «سازمان جهانی بهداشت» به عمل میآمد، مد نظر قرارگرفت. این سازمان از کشورهای عضو خواست که فهرست کاملاً تازهای از منابع درمانی خود، که گیاهان طبی در آن، هنوز جای مهمی دارند، تهیه کنند.بدون تردید چنین تحقیقاتی منجر به کشف داروهای جدید، و ایجاد و تکامل نظریات جدید نسبت به درمان بیماری خواهد شد. نیازی به توضیح نیست که خردمندی و حس عمیق تجربهگرایی پیشینیان، غالباً منجر به آن میشد که علیرغم سکونت در قارههای مختلف، برای معالجه فلان عارضه، از داروی طبیعی یکسانی استفاده کنند. چنانکه ساکنان منطقه حاره، برای چاره کردن بیماری جذام، از مواد حاصل از خانواده نباتیِ یکسانی به نام «فلاکورتاسئا» استفاده میکردهاند. به عبارت دیگر معالجهگرانی که هزاران کیلومتر دور از یکدیگر میزیستند، بدون آنکه از وجود دیگری خبر داشته باشند، از گیاهان مشابهی که گیاهشناسان امروزی در یک طبقه جای میدهند، داروهای یکسانی تهیه میکردند. به عنوان مثال هم «اینکا»ها و هم چینیها، متوجه شده بودند که زنبق آبی برای تسکین درد و نقصان قوه باء خاصیت دارد.برخورد به چنین تشابهاتی توجه انسان را به سودمندی داروهایی که در زمانهای مختلف توسط جوامع مختلف کشف شدهاند جلب میکند. امروزه تعدادی از کشورها متابع قابل توجهی را صرف ارزیابی مجدد و بررسی علمی سنتهای درمانی خود میکنند. انجام اقداماتی از این قبیل در سراسر جهان، نه تنها باعث غنای میراث فرهنگی هر یک از ملتها و جوامع و تمدنها خواهد شد، بلکه همچنین، منابع بیشتری را در اختیار طب جدید خواهد گذاشت. با این همه چنین پیشرفتی مستلزم برخوردی کاملاً نو به گیاهان طبی است. پس از دهها سال پژوهشهای تحلیلی به منظور استخراج مواد خاص فعال موجود در گیاهان، اکنون باید تاکید را در بهرهبرداری از کل گیاه قرار داد. از این لحاظ برخی از اطلاعات کاملاً جدید بومشناختی (اکولوژیک) ممکن است به کار آید. برای یک بوم شناس (اکولوژیست) یک معلول معین، به هیچوجه محصول یک علت واحد نیست، بلکه حاصل برخورد یک رشته پدیدههای همزمان است. بنابراین در یک نظام پیچیده، کل آن نظام از حاصل جمع اجزای آن فراتر است و درک اولی تنها با شناخت دومی به دست نمیآید. کار کردن ماشین طبیعت حاصل جمع عمل اجزای آن که به طور همزمان و در کنار یکدیگر باشند نیست، بلکه برآیند کنشهای متقابل فراوان بین آنها است. درست به همانگونه که ماده و حیات، با فراگذشتن از درجه معینی از پیچیدگی، خواص نوینی کسب میکنند. حال اگر گیاهان طبی را در نظر گیریم، نظریه فوق به طریق استقرایی، نظریههای سنتی را که مطابق آنها یک گیاه در تمامیت خود واجد خواصی است که از خواص اجزای متشکله آن متفاوت است، تایید میکند. نمونههایی که بیش از همه در تایید این نظر ذکر میشود، خواص کلی ارجوت، تریاک یا دیژیتال است که با خواص تک تک مواد موجود در آنها آشکارا متفاوت است. اما این نمونهها آنچنان منجز هم نیستند، چه با اندکی توجه به منطق دکارتی، روشن میشود که خواص یک مخلوط عبارت است از جمع جبری خواص مواد تشکیل دهنده آن. حال آنکه آزمایش با انگنار، در این مورد نتایج بهتری به دست میدهد. بنا بر نظریه علایم، با مصرف این گیاه تلخمزه، عمل کبد باید بهتر انجام گیرد، و در واقع چنین نیز هست. در ابتدا خاصیت مورد بحث به یک ماده واحد موجود در این گیاه نسبت داده میشد، و سپس کشف شد که مواد دیگری نیز در این قضیه سهم دارند. با این حال وقتی که این مواد به طور جداگانه بر روی موش آزمایش شد، معلوم شد که اکثر آنها به صورت تنها کاملا بیاثر هستند. از سوی دیگر، آزمایش مخلوط این مواد، به مقدار مساوی نشان داد که هر چه تعداد مواد در مخلوط بیشتر باشد، اثر آنها قاطعتر است. به عبارت دیگر این امر به خوبی نشان میدهد که چگونه با امتزاج موادی که به صورت تنها بیاثرند، خواص فعال جدیدی بروز میکند. بدون شک چنین پدیدهای در مورد سایر گیاهان، مثل خفچه و سنبلالطیب نیز صادق است. هرچند که ماهیت دقیق اجزای متشکلة آنها هنوز به درستی تعیین نشده است. درست به همانگونه که نفع عمومی چیزی متفاوت از حاصلجمع منافع فردی افراد جامعه است، خواص یک داروی معین نیز از حاصل جمع خواص تمام مواد تشکیلدهنده آن متفاوت است. این به آن معنا است که لازم است برخورد کاملاًجدیدی نسیت به مطالعه گیاهان طبی پدید آید و نیز داروشناسی خاص، آنچنان پیش برود که تمام ماهیت و خواص آنها به نحو مقنعتری دانسته شود.چنین است که به عنوان مثال، مطالعات پروفسور ماسکلیه از دانشگاه بوردو، درباره کف یک جنگل کاج، منجر به کشف داروی مهمی شد که در معالجه اختلالات دستگاه گردش خون به کار میرود. ماسکلیه با دریافتن این نکته که در کف چنین جنگلهایی سبزه نمیروید به این فکر افتاد که شاید، علت آن باشد که سوزنبرگهای مرده کاج، محتوی مادهای است که از جوانهزدن دانههای سبزه جلوگیری میکند. آزمایشهایی که به روی جوشانده سوزنبرگهای مرده انجام شد، نشان داد که چنین چیزی واقعاً وجود دارد و اثر آن بسیار قوی است. پروفسور ماسکلیه توانست آن ماده را استخراج کرده و مورد آزمایش قرار دهد، که در نتیجه آن معلوم شد که این ماده دارای اثر بسیار نیرومندی است که فعل و انفعالات هورمونی حاکم بر طویل شدن و تقسیم سلولهای سبزه را مختل میکند. همچنین معلوم شد که همین ماده از رشد جنبههای مضر در سلولهای انسان جلوگیری میکند. به هر حال هنگامی که برای تولید آن از طریق مصنوعی کوشش به عمل آمد، معلوم شد که تنها پلیمرها واجد چنین خاصیتی هستند، (پلیمرها موادی مرکب از مولکولهای بسیار بزرگند که از ترکیب واحدهای شیمیایی سادهتر به نام مونومر حاصل میشوند). و اما هنگامی که این مواد را به دیمرها تجزیه کردند (دیمر حاصل ترکیب دو مولکول است) معلوم شد که تحت تاثیر آنها، مقاومت مویرگهای خونی افزایش مییابد و نتیجتاً سیستم قلب و عروق تقویت میشود. به این ترتیب مطالعه علت عدم رشد سبزه در جنگل کاج، همراه با جستجوی ترکیبات درمانی جدید، منجر به کشف درمان جدیدی برای بیماریهای دستگاه گردش خون با استفاده از ماده موجود در سوزنبرگهای کاج شد. این قضیه نشان میدهد که چگونه پژوهشهای علمی، برای رسیدن به نتایج مثبت، گاهی باید از راههای کاملاً بدیع و پرپیچ و خم بگذرد. جریاناتی سادهتر از این هم هست و آن، آزمایشهایی است که به منظور یافتن خواص گیاهان به طور منظم به روی آنها انجام میگیرد. همه ساله چنین آزمایشهایی در آزمایشگاههای موسسات صنعتی و دانشگاهی در مورد هزاران نوع گیاه، توسط محققان داروهای گیاهی در چهارگوشه جهان صورت میگیرد.امور طبیعت علی رغم ظواهر آن از نظم برخوردار است و فراگردهای شیمیایی گیاهان نیز به هیچوجه بیحساب نیست. در میان گیاهان یک «روح خانوادگی» موجود است و هر خانوادهای نوع خاصی از فعل و انفعالات شیمیایی را به بار میآورد، درست به همانگونه که نوع خاصی از گل را بهوجود میآورد.به هر حال، صرفنظر از هر مسیری که در پژوهشها اتخاذ شود، در سراسر دنیا نسبت به مطالعه گیاهان دارویی اقبال جدیدی دیده میشود و نشانههای امیدوارکنندهای دال بر توجه کشورهای در حال توسعه به داروهای سنتی خود به چشم میخورد. این کشورها به تشویق سازمان جهانی بهداشت مبنی بر اینکه احتیاجات درمانی مردم خود را از منابع خود تامین کنند و با استفاده از مکاتب طب سنتی، تمدن خود از اتکا به واردات سنگین داروهای خارجی ـکه برتری آنها نیز همواره قطعی نیستـ بکاهند به این سو روی آوردهاند. امروزه نیز همچون گذشته، دنیای گیاهان طبی دنیای وسیعی است که افقهای دوردستی را در برابر پژوهشها و پیشرفتهای پزشکی گسترده است.
آسپرین داروی معجزه آسا
چند رشته مطالعات تازه نشان می دهد که آسپیرین می تواند در برابر سرطان دهان، حلق و مری و همچنین روده از بدن محافظت کند.از یک سو محققان ایتالیایی می گویند که مصرف مرتب آسپیرین برای مدت پنج سال خطر ابتلا به سرطان دهان، حلق و مری را به میزان دو سوم کاهش می دهد و دو گروه دیگر در آمریکا از تاثیر مثبت آسپیرین در پیشگیری از سرطان روده خبر می دهند.این یافته ها بر شواهد قبلی که نشان می دهد آسپیرین یک داروی معجزه آساست می افزاید.مطالعات قبلی نشان داده است که این قرص، که بیش از یک قرن پیش ساخته شد، می تواند به پیشگیری از سرطان ریه کمک کند.اکثر مردم این دارو را برای تسکین درد به کار می برند، اما استفاده از آن برای حفاظت در برابر بیماری های قلبی و حتی آرتروز نیز رایج است
تاریخچه وقتى نخستین بار در سال ۱۷۶۳ از پودر پوست درخت بید براى تسکین بیمارى که از تب رنج مى برد استفاده کردند کسى فکرش را نمى کرد که سال ها بعد دارویى را از آن کشف کنند که جان میلیون ها نفر را از خطر مرگ نجات دهد. در آن سال یک کشیش انگلیسی به نام ادوارد استون مقالهای در جلسه سلطنتی انگلستان ارائه دادکه در آن استفاده از برگ درخت بید را حتی در درمان مالاریا نیز موثر معرفی کرده بود. ۱۰۰ سال پس از مقاله استون، یک پزشک اسکاتلندی دریافت که با استفاده از مادهای که از برگ درخت بید بدست میآید، عوارض ناشی از رماتیسم به طرز معجزه آسایی کاهش مییابد.
آسپیرین را چه کسی کشف کرد؟
فردریک بایر (Fredrich Bayer) در سال ۱۸۲۵ بدنیا آمد. پدر او یک نساج و رنگرز پارچه بود و طبق عادت آن زمان وی در ابتدا شغل و حرفه پدر را برای کار انتخاب کرد و پس از مدتی فعالیت با پدر، در سال ۱۸۴۸ تشکیلاتی مشابه برای خود راه اندازی کرد و در آن حرفه بسیار هم موفق شد.
تا قبل از ۱۸۵۶ برای رنگرزی از مواد رنگی طبیعی استفاده می شد اما با کشف و صنعتی شدن ساخت رنگهای حاصل از مواد نفتی، بایر که پتانسیل موجود در این کشف را بخوبی احساس کرده بود با کمک شخصی بنام فردریک وسکوت (Friedrich Weskott) کمپانی Bayer را راه اندازی کرد.
بایر در ماه می سال ۱۸۸۰ در گذشت و تا آن زمان کمپانی هنوز در فعالیت رنگرزی مشغول بود، اما شرکت تصمیم گرفت با استخدام تعدادی شیمیدان نوآوری هایی در این صنعت بوجود آورد و این اتفاق هم افتاد اما نه در صنعت رنگرزی.
هنگامی که فلیکس هوفمن (Felix Hoffmann) در حال انجام آزمایش با یکسری از ضایعات رنگی بود تا شاید بتواند دارویی برای درمان درد ناشی از بیماری پدرش بدست آورد توانست به پودری دسترسی پیدا کند که امروزه شما آنرا به نام آسپرین می شناسید. هوفمن آسپرین را کشف نکرد:
آسپرین چهل سال قبل توسط یک شیمیدان فرانسوی کشف شده بود، این شیمیدان بخوبی می دانست که پودر اسید استیل سالیسیلیک (acetylsalicylic acid) دارای خاصیت شفا بخشی بسیار می باشد. در واقع بیش از ۳۵۰۰ سال بود که بشر این پودر را می شناخت چرا که در سال ۱۸۰۰ یک باستان شناس آلمانی که در مصر تحقیق می کرد، با ترجمه یکی از پاپیروس های مصری متوجه شد که بیش از ۸۷۷ نوع مواد دارویی برای مصارف مختلف در مصر باستان شناخته شده بود که یکی از آنها همین پودر اسید بود که برای برطرف کردن درد از آن استفاده می شد.
در برخی از شواهد و نوشته های دیگری که در یونان بدست آمده است نیز مشخص شده که بشر حدود ۴۰۰ سال پیش از میلاد از شیره پوست درخت بید برای درمان تب و درد استفاده می کرده است. همچنین آنها هنگام زایمان زنان از این ماده برای کاهش درد استفاده می کردند. امروزه مشخص شده که ماده موجود در این شیره چیزی جز اسید سالیسیلیک نیست. ثبت رسمی کشف آسپرین:
ماه مارچ ۱۸۹۹ کمپانی بایر رسما” محصول خود بنام آسپرین را به ثبت رساند و به دنبال آن در سایر کشورهای جهان نیز تحقیقاتی گسترده راجع به این دارو انجام گرفت بگونه ای که هنگام بازنشستگی هوفمن در سال ۱۹۲۸، آسپرین در تمام دنیا شناخته شده بود. سپس شیمیدانان آلی بر آن شدند که این ماده را شناسایی و جداسازی کنند. و پس از تلاش فراوان یک کربوکسیلیک اسید همراه با یک عامل فنلی را شناسایی کردند و به مناسبت منبع آن که درخت بید یا سایدکس بوده آن را سالیسیلیک اسید نامیدند.
سنتز استیل سالیسیلیک اسید (آسپرین) :
بوسیله استیله کردن عامل OH در سالیسیلیک اسید براحتی میتوان آسپرین تهیه کرد. این کار به روشهای متفاوتی امکان پذیر است. یکی از این روشها استفاده از استیک انیدرید در محیط اسیدی می باشد که با توجه به نقش کاتالیستی اسید معمولا در حضور استیک اسید یا سولفوریک اسید انجام می شود.
روش مورد بحث دیگر استفاده از استیل کلرید در حضور پیریدین می باشد.
شرح کار : در ابتدا یک ارلن خشک را برداشته و gr3 سالسیلیک اسید و cc5 انیدریک استیک و ۲ الی ۳ قطره اسید سولفوریک غلیظ را مخلوط کرده و آن را به طور کامل تکان می دهیم و روی بن ماری ۶۰ درجه سانتی گراد به مدت ۲۰ دقیقه حرارت می دهیم ، بعد از سرد شدن cc30 آب معمولی را کم کم به ارلن اضافه می کنیم و آنقدر هم می زنیم تا رسوب تشکیل شود و بع آن را توسط کاغذ صافی ، صاف می کنیم .
مقدمه:
بنزیلیک اسید (α_هیدروکسی دی فنیل استیک اسید )جامد سفید رنگی است با نقطه ذوب ۱۵۱ درجه سانتی گراد و جرم مولکولی ۲۲۸ می باشد.
هیدرولیز به معنای شکسته شدن توسط آب می باشد.در محیط اسیدی H2O و در محیط بازی OH به عنوان نوکلئوفیل با مولکول آلی وارد واکنش می گردد.
بنزیل در محیط قلیایی به بنزیلیک اسید تبدیل می گردد:
از هیدرولیز دی کتونها کربوکسیلیک اسیدها حاصل می شوند.اگر بنزیل را با یک باز قوی حرارت دهند به نمک α-هیدروکسی دی فنیل استات تبدیل می گردد.این نوآرایی درون مولکول با افزایش یون هیدروکسید به دی کتون شروع شده و با انتقال گروه آریل با الکترونهای پیوندش (نوآرایی کربانیون) به اتم کربن مجاور ادامه می یابد.همزمان با آن پروتون مولکول تغییر مکان داده و آنیون پایدار تشکیل می گردد.
شرح کار:
۵/۲ گرم هیدروکسید پتاسیم را در ۱۰ میلی لیتر آب در یک بالن حل کنید و سپس ۶ میلی لیتر اتانول و ۵/۲ گرم بنزیل به آن اضافه کنید و به همراه چند عدد سنگ جوش به مدت ۳۰-۲۰ دقیقه رفلاکس کنید سپس سیستم را خاموش کرده و محتوی بالن را در داخل یک بشر ۱۰۰ میلی لیتر ریخته اجازه دهید سرد شود و آن را در داخل حمام یخ بگذارید و به آرامی حدود ۱۰ میلی لیتر اسید کلریدریک غلیظ اضافه کنید تا محلول اسیدی شود (با کاغذ تورنسل امتحان کنید زیرا اگر اسید زیاد بریزید امکان دارد مولکول ها بشکند.) بلورهای اسید بنزیلیک به دست آمده را روی قیف بوخنر صاف کنید و آن را مقدار کمی آب مقطر کاملا سرد بشویید تا عاری از کلریدها گردد و بگذارید تا خشک شود رنگ محصول به دست آمده و وزن آن را گزارش نمایید
مقدمه و تئوری :
استری کردن نمونه ای از یک واکنش تراکمی است که با حذف درون مولکولی و یا بین مولکولی یک مولکول کوچک تقطیر H2O از واکنش گرما همراه است در طی این واکنش استر از اجزای سازنده خود یعنی اسید و الکل یا استوکیومتری زیر به وجود می آید :
R COOH + HOR/ + H2O
استر ها معمولا از واکنش الکل ها و یا فنل ها با اسید های کربوکسیلیک و یا مشتقات آنه تهیه می گردند .
حضور گروههای حجیم در نزدیکی محل انجام واکنش خواه در اسید ها یا الکل استری شدن را آهسته می سازد . در زیر فعالیت الکلها و اسید ها را در استری شدن مشاهده می نمایید این مطلب در آبکافت استرها نیز صدق می نماید .
الکل ها CH3OCH > 10 > 20 > 30
HCOOH > CH3COOH > RCH2COOH > R2OH COOH > R3CCOOH
چون این فرایند برگشت پذیر است حذف فراورده های جانبی (آب ) به تولید محصول بیشتر و کامل شدن واکنش کمک می کند . در استری کردن به روش فیشری از گاز HCL به عنوان کاتالیزگر استفاده می شود . اما استری شدن اسیدهای کلرید آروماتیک ArCOCl معمولاً در حضور باز انجام می گیرد .
در هیروکسی اسید ها که دارای هم عامل ایدی و هم عامل الکلی هستند اگر یک حلقه پنج یا شش ضلعی تشکیل شود استری شدن درون مولکولی اتفاق می افتد . بنابراین یک گاما و یا آلفا هیدروکسی اسید خود به خود آب از دست می دهد و یک استخر حلقوی را (ن کتون ) تولید می کند
شرح کار :
ابتدا یک بالن ۱۰۰ سی سی را برداشته و مقدار cc15 اتانول مطلق ، cc30 استیک اسید و cc1 اسید سولفوریک غلیظ و چند عدد سنگ جوش را باهم مخلوط کرده و به مدت نیم ساعت رفلاکس می کنیم . بعد از سرد شدن به محتویات بالن cc5 آب نمک اشباع اضافه می کنیم و درون قیف جدا کننده جداسازی دو انجام می دهیم . فلز روی حاوی اتیل استات ( استر ) خواهد بود .
در ساده ترین مورد تقطیر مایع را در اثر حرارت تبخیر کرده وبخارهای حاصل را در یک مبرد به صورت مایع جمع آوری می کنند.چون در اینجا فقط یک فاز یعنی بخار حرکت می کند از تقطیر جریان ثابت (تقطیر ساده) صحبت می شود. اگر برعکس یک قسمت از بخار مایع شده در جهت عکس سقوط بخار دائما" به داخل بالون تقطیر باز گردد.با یک تقطیر جریان مستقیم سرو کار داریم،تقطیر جریان متغییر یا تقطیر جزبه جز در ستونهای تقطیر انجام می گیرد. برای جدا سازی
مخلوطهایی از تقطیر جز به جز استفاده می شود که دارای دو جز با دمای جوش مختلف باشد.در این حالت به جای آنکه چندین بار تقطیر ساده را انجام دهیم از تقطیر جز به جز استفاده می کنیم.این روش به کمک ستونهای تقطیر زمانی مورد استفاده قرار می گیرد که برای جدا کردن یک مخلوط تقطیر ساده کافی نباشد.چنانچه اختلاف فراریت اجسامی که باید از یکدیگر جدا شوند چندان کافی نباشد در این صورت نمی توان آنها را با یک بار تبخیر از هم جدا کرددر این گونه موارد عمل تبخیر باید تحت شرایطی چندین بار تکرار شود. با کمک ستونهای تقطیر این خواسته می تواند در یک مرحله انجام شود.اغلب برای مبتدی روشن نیست که چه موقع عمل تقطیر جز به جز با ستونهای تقطیر ضرورت دارد. اغلب قابلیت جداسازی در تقطیر ساده جریان ثابت بیش از آنچه هست براورد می شود. به عنوان قانون کلی می توان گفت در مواردی عمل تقطیر جز به جز باید انجام گیرد که اختلاف نقطه جوش موادی که باید از هم جدا شوند کمتر از 80 درجه سانتیگراد باشد. از تقطیر جز به جز برای جدا کردن مخلوط مایعاتی استفاده می شود که ایده آل باشند یعنی اجزای مایع مشابه هم باشند. و با هم برهمکنشی نداشته باشند.وبه هر نسبتی با هم مخلوط شوند. (نه جاذبه خاصی باشد نه دافعه و هر دو مایعات مستقل عمل کنند )یعتی مخلوط مایع از قانون رائول پیروی کند.
اگر مایعات دارای جاذبه باشند فشار بخار کمتر می شود پس مایع دیر تر می جوشد نقطه جوش مخلوط بیشتر از تک تک اجزا خواهد بود و بر عکس اگر مایعات دارای دافعه باشند فشار بخار بیشتر می شود. پس مایع زودتر می جوشد و دمای مشاهده شده کمتر از دمای تک تک اجزا خواهد بود چنین مخلوطهایی را آزئوتروپ می گویند. مخلوط آزئوتروپ را نمی توان به روش تقطیر از یکدیگر جدا کرد.زیرا فاز مایع و بخار دارای ترکیب یکسان هستند. آزئو تروپهای معروف عبارتند از :محلول هیدروژن برمید با نقطه جوش ثابت ومحلول آبی الکل 96 درصد.در این مخلوطها دمایی که دما سنج نشان می دهد دمای
هیچکدام از اجزای مخلوط نیست.
روش عملی کار شده:
مخلوط استون دارای نقطه جوش را با آب مخلوط می کنیم دو جرئی هستند که در این آزمایش مورد استفاده قرارمی گیرد.
یک دستگاه تقطیر جز به جز از اجزای زیر تشکیل شده است: 1-بالون تقطیر جهت تبخیر مایع(ماده اولیه)
2- ستون تقطیر
3-سرپوش ستون تقطیر( در اینجا اندازه گیری دما تراکم بخار وتوزیع بخار متراکم به حالت رفلاکس ومحصول تقطیر انجام می گیرد. )
4- ظرف جمع کننده
انتخاب ستون تقطیر به اشکال جداسازی ،مقدار مایعی که باید تقطیر شود،ودامنه فشاری که در آن تقطیر انجام می شود.بستگی دارد.
مخلوط استون به دلیل ناخالصی از دمای 80 درجه شروع به جوشیدن و بخار شدن می کند ولی آب در این دما نمی جوشد.استون تبخیر شده و با عبور از ستون تقطیر در ظرف جمع کننده به صورت استون خالص جدا سازی می شود. که دمای جوش استون است که در طی عملیات جداسازی این ماده دما تغییر نمی کند. پس از جدا شدن کامل استون ظرف جمع کننده را عوض می کنیم واستون خالص را به ظرف دیگر انتقال می دهیم ظرف جمع کننده دیگر را به دستگاه متصل کرده ومنتظر جوشیدن آب می مانیم که دمای جوش آب حدود 94 درجه سانتیگراد مشاهده شد. از دستگاههای مورد استفاده در این آزمایش شوف بالون برای حرارت وستون تقطیر است که بین بالون و مبرد قرار می گیرد. مخلوط را حرارت می دهیم بخارات بالا می آیند تا قسمتی از لوله،که در قسمتی خاصی دما به اندازه ای نیست که آب را بخار کند .ولی بخارات استون که در آن دما می توانند باشند به دماسنج برخورد می کنند و دما را نشان می دهد.
عنوان : تهيه پارانيترو استانيليد
روش كار:
در يك لوله آزمايش تهيه كرده ودر حمام يخ سرد كنيد.
|
Reactants and Products
|
MW (g/mol)
|
Amounts
|
Wt./MW = mol
|
Density (g/mL)
|
Mp or Bp (°C)
|
|
Acetanilide
|
135.17g/mol
|
0.5g
|
0.004 mols
|
-----------
|
Mp= 113-115°C
|
|
Nitric acid
|
63.01
|
0.5mL
(0.6915g)
|
0.012 mols
|
1.383g/mL
|
Mp = -42
Bp = 121
|
|
Sulfuric acid
|
98.08g/mol
|
1.6mL
(2.944g)
|
0.030 mols
|
1.84g/mL
|
Mp = 3
Bp = 280
|
|
nitroacetanilide
|
180.16g/mol
|
0.23g
|
0.0013 mols
|
-----------
|
Mps: Ortho = 94°C
Meta = 155°C
Para = 214-217°C
|
|
Ethanol, 95%
|
46.07g/mol
|
10mL
(7.89g)
|
0.171 mols
|
0.789g/mL
|
Bp = 78°C
|
چرا پارا نیترو استانیلید در محلول های اسیدی حل می شود؟
C6H5-NH(C=O)CH3 استانیلید می باشد که در آن گروه NHCOCH3 بر روی حلقه ی آروماتیکی وجود دارد. حال چنانچه بخواهیم یک گروه دیگر بر روی حلقه قرار دهیم، این گروه می تواند موقعیتهای ارتو، متا و پارا را اشغال نماید. یعنی گروه جدید همسایه ی گروه قبلی باشد (ارتو) و یا یک کربن از آن فاصله داشته باشد(متا) و یا دو کربن فاصله داشته باشد و در دورترین فاصله ی ممکن قرار گیرد (پارا).
استانیلید دارای نقطه ذوب 113 تا 115 درجه ی سانتیگراد و نقطه جوش 304 درجه ی سانتیگراد می باشد.
ارتو و پارا نیترواستانیلید بوسیله ی واکنش استانیلید با مخلوطی از نیتریک اسید و سولفوریک اسید بدست می آید. زیرا گروه نخست یعنی NHCOCH3 گروه حجیمی است، فرم پارا که در آن دو گروه فوق و نیترو از هم فاصله ی بیشتری دارند، پایدارتر بوده و قسمت بیشتر محصول را به خود اختصاص می دهد. اما جدا کردن ایزومرهای پارا و ارتو از طریق تقطیر جز به جز ممکن است، زیرا ابن دو ترکیب در نقطه ی جوش متفاوت هستند.
اما دلیل حل شدن، به طور کلی یا حل شدن بر اساس شبیه در شبیه است یعنی مواد مشابه در حلالهای مشابه از نظر میزان قطبی حل می شود
و یا اینکه حل شونده و حلال بتوانند با هم برهمکنشی داده و پیوندی برقرار نمایند مانند حل شدن برخی مواد مانند شکر در آب به دلیل توانایی برقراری پیوند هیدروژنی
در مورد مولکول فوق همانطور که گفته شد به دلیل اینکه در نوع پارا ، ممانعت فضایی کمی در مولکول حاکم است، پایداری بیشتری وجود دارد و چون دو گروه به اندازه کافی از هم فاصله دارند، نیتروژن می تواند با هیدروژن اسیدی پیوند داتیو برقرار نماید و به دلیل تراکم الکترون در برخی قسمتها ، مولکول قطبی بوده می تواند در محلولهای اسیدی که انها هم به نوعی قطبی هیتند حل شوند.
خطای آزمایش:
چون این واکنش گرمازا است، باید افزایش استانیلید به اسید نیتریک غلیظ بسیار آهسته و همراه با سردکردن محیط واکنش صورت گیرد.
نتیجه گیری:
در پارا نیترو استانیلید، پیوندهای هیدروژنی درون مولکول و بین دو گروه عاملی برقرار می شود ولی در ایزومر ارتو، پیوندهای هیدروژنی بین مولکولهای مجاور و نه در یک مولکول برقرار می شود.
هنگام تولید نیترو استانیلید فرم پارا که در آن دو گروه فوق و نیترو از هم فاصله ی بیشتری دارند، پایدارتر بوده و قسمت بیشتر محصول را به خود اختصاص می دهد. در این گروه به دلیل فاصله ای که گروههای عاملی دارند، ازدحام فضایی کمتر بوده و مولکول بزرگتر می شود، درنتیجه نیروهای بین مولکولی نیز قویتر شده و مولکول به صورت جامد در می آید.
دریافت گزارش کار سنتز فنیل هیدروکسیل آمین
لینک مستقیم از مدیا فایر : دانلود
لینک مستقیم از پرشین گیگ : دانلود
هدف از آزمايش: آشنايي با تهيه دي بنزال استون
مواد لازم: آب، سديم هيدروكسيد ، اتانول، استون ، اتيل استات بنزالدهي.
وسايل لازم: ارلن ماير،استوانه مدرج، بشر ،قیف بوخنر ،كاغذ صافي.
تئوری:
اگر مخلوط آلدئیدها و یا کتونهای متفاوت و یا هر دوی آنها در محیط حضور داشته باشند، منجر به تولید محصولات تراکمی متنوع میشود. در مورد کتونهای دارای دو گروه متیلن یا در حالت خاص دو گروه متیل مثل استون اگر نسبت مولی بنزآلدئید به استون به صورت 2 به 1 باشد دی بنزال استون به جای بنزال استون تشکیل میشود.
روش كار:
4گرم سديم را با 20 ميلي ليتر آب در يك ارلن ماير 250 ميلي ليتر ریختیم و تكان دادیم تا حل شود.در مرحله ی بعد 20 ميلي ليتر اتانول به مخلوط اضافه كردیم و سپس صبر کردیم تا کمی سرد شود.( بعد از اضافه کردن اتانول و قبل از اضافه کردن استون و بنزآلدهید برای جلوگیری از واکنشهای جانبی و کانیزار باید اجازه داد تا دمای ظرف به دمای اتاق(آزمایشگاه) برسد) .در یک استوانه ی مدرج 6cc بنز الدئید وgr 3 استون را با هم مخلوط کردیم.نیمی از محلول استوانه مدرج را به ارلن اضافه کردیم و به مدت 5 دقیقه به هم زدیم . رنگ محلول به سرعت به زرد تا نارنجي تغيير کرد (رنگ به خلوص بنزالدهيد بستگي دارد) سپس نیمی دیگر از محلول را که در استوانه ی مدرج باقی مانده بود به ارلن اضافه کردیم واین بار 15 دقیقه به هم زدیم
(مخلوط گرم ميشود و تقريبا بي درنگ رسوب زرد رنگ حاصل ميشود).سپس مخلوط را روي قيف بوخنر صاف كردیم محصول را با كمي الكل سرد شستیم و اجازه دادیم تا خشك شود سپس رسوب خشک شده را توزین کردیم و راندمان آنرا مطابق مراحل زیر به دست آوردیم
محاسبات :
6 ÷ 106.13 = 0.056
3 ÷ 58.08 = 0.051 (محدود کننده)
محدود کننده / جرم مولی = X / جرم مولی دی بنزال استون (محصول)
در نتیجه :
0.051 / 58.08 = X / 248 0.217 (مقدار نظری)
راندمان = مقدار عملی / مقدار نظری × 100
در نتیجه :
وزن رسوب / 0.217 × 100 = ؟
خطای آزمایش :
بعد از اضافه کردن اتانول و قبل از اضافه کردن استون و بنزآلدهید برای جلوگیری از واکنشهای جانبی و کانیزار اجازه دهید تا دمای ظرف به دمای اتاق(آزمایشگاه) برسد.
نتیجه گیری:
در این آزمایش از بنزآلدهید به عنوان الکترون دوست و از استون به عنوان هسته دوست استفاده می شود
مواد لازم : بنزن ، نیتریک اسید غلیظ ( 70 درصد ) ، سولفوریک اسید غلیظ ( 98 درصد)
احتیاط : با دستکش و زیر هود با سولفوریک اسید و نیتریک اسید کار کنید . در صورت ریختن اسید ، سدیم بی کربنات یا سدیم کربنات جامد روی آن بپاشید.
خطر : نیتریک اسید ، یک اکسنده قوی است . از تنفس بخارات آن و تماس با پوست بدن و چشم اجتناب کنید سولفوریک اسید یک ماده شدیداً جاذب الرطوبه است و سبب سوختگیهای جدی می شود.
روش کار:
در یک بالن ته گرد ( 250 میلی لیتری ) ، 5/15 میلی لیتر نیتریک اسید غلیظ بریزید و به آن ، در حال همزدن و به آرامی ، 5/12 میلی لیتر سولفوریک اسید غلیظ بیفزایید . مخلوط را در حمام آب و یخ قرار دهید و وقتی دمای مخلوط به 50 درجه سانتیگراد رسید ، 5/8 میلی لیتر بنزن را کم کم ( هر بار حدود 2 میلی لیتر ) به مخلوط اضافه کنید و به طور مداوم مخلوط را به هم بزنید . در طول افزودن بنزن ، دمای واکنش نباید از 55 درجه بیشتر شود . سپس با قرار دادن یک مبرد ، مخلوط را در حمام آبی که دمای آن حدود 60 درجه است ، رفلاکس ( بازروانی ) کنید و گاهی مخلوط را تکان دهید . پس از 45 دقیقه واکنش انجام شده است . آنگاه محتویات بالن را در 80 میلی لیتر آب بریزید و به خوبی هم بزنید . بدین ترتیب اسید تا حد امکان از لایه نیترو بنزن جدا می شود و در لایه آبی قرار می گیرد . لایه آبی را جدا کنید . نیترو بنزن را در قیف جدا کننده بریزید و آن را سه بار ، هر بار با 10 میلی لیتر آب ، بشویید . پس از آن ، 4 بار ، هر بار با 10 میلی لیتر محلول رقیق سدیم کربنات 7 درصد شستشو دهید . ( در هر بار استخراج ، خروج گاز از قیف جدا کننده را مد نظر داشته باشید . ) در آخرین استخراج نباید ، گاز CO2 تولید شود . نیترو بنزن فاقد اسید را بوسیله کلسیم کلرید ، خشک کنید ( حدود 20 دقیقه ) . سپس آن را در یک بالن صاف کنید و با سوار کردن دستگاه تقطیر خشک ، تقطیر کنید . دمای جوش نیترو بنزن حدود 205 الی 210 درجه سانتیگراد است . نیترو بنزن تقطیر شده را در یک لوله آزمایش که وزن آن را قبلاً به دست آورده اید جمع آوری کنید . توجه داشته باشید که نیترو بنزن بسیار سمی است.
روش کار:
8 میلی لیتر آنیلین را با استفاده از یک استوانه مدرج در یک ارلن مایر 500 میلی لیتری بریزید ، ( آنیلین سمی است از تماس آن با پوست اجتناب کنید ) ، سپس 60 میلی لیتر آب به ارلن مایر اضافه کنید . در حالی که ارلن مایر را می چرخانید ، 10 میلی لیتر استیک انیدرید را کم کم به مخلوط اضافه کنید . در این حالت استانیلید ، رسوب می کند که محصول خام است و برای تخلیص باید آن را متبلور کرد . بنابراین ، 200 میلی لیتر آب با یک سنگ جوش در ارلن حاوی استانیلید بریزید و روی چراغ گاز که توری روی آن قرار دارد ، گرم کنید . و وقتی رسوب و مایع روغنی حل شد گاز را خاموش کنید . یک میلی لیتر از محلول را در داخل یک بشر کوچک بریزید و بگذارید سرد شود . قبل از گرم کردن مجدد ارلن مایر ، حدود یک گرم زغال به منظور رنگ زدایی و خلوص بیشتر ، به مخلوط اضافه کنید و مخلوط را به هم بزنید و صبر کنید تا چند دقیقه به آرامی بجوشد . نباید زغال را به محلول در حال جوشیدن اضافه کرد . در طول این مدت وسایل صاف کردن معمولی را آماده کنید . از قیف دم کوتاه ، کاغذ چین دار و ارلن مایر 500 میلی لیتری استفاده کنید . 100 میلی لیتر آب جوش برای شستن رسوبها و گرم کردن قیف لازم است . روی قیف 20 میلی لیتر آب داغ بریزید و سپس محلول داغ را صاف کنید . در طول صاف کردن ، محلول را روی حمام بخار گرم نگاه دارید و بهتر است عمل صاف کردن با گذاردن ارلن و قیف بر روی حمام بخار انجام پذیرد . اگر بلورها در قیف تشکیل شد ، قدری آب داغ اضافه کنید تا بلورها حل شوند . رسوبات ته ارلن را نیز با آب داغ بشویید و صاف کنید . پس از صاف کردن ، صبر کنید تا محلول سرد شود . برای کامل شدن عمل تبلور ، ارلن مایر را مدت 15 دقیقه در حمام یخ بگذارید . سپس بلورها را با استفاده از قیف بوخنر صاف کنید . بلورهای حاصل را روی شیشه ساعت بریزید تا خشک شود ( یک شب طول می کشد ) . حال نقطه ذوب و حالت ظاهری محصول خالص و متبلور را با محصول خام پیش از استفاده از زغال ، مقایسه کنید .
مکانیسم واکنش تهیه استانیلید :
مقدمه:
اکسیمها ترکیباتی هستند که دارای گروه عاملی زیرهستند و اتم کربن برای تکمیل هشت تایی خود به دو گروه دیگر نیز متصل می شود.
OH-N=C
یکی از مهمترین مشتقاتی که برای شناسایی آلدهیدها و کتون ها ساخته می شود مشتق اکسیم است.اکسیم ها از واکنش هیدروکسیل آمین هیدروکلراید با آلدئیدها و کتونها بدست می آید .کلیه کتون ها مخصوصا کتونهای حلقوی و مایع به سرعت به اکسیم تبدیل می شوند.اکسیم ها غالبا جامداند و برای شناسایی آلدئید و کتون ها بکار می روند.
برخی از ترکیبات مرتبط با آمونیاک می توانند در محیط اسیدی به گروه کربونیل افزوده شوند و مشتقهایی تشکیل دهد که بیشتر برای مشخص کردن و شناسایی آلدهیدها و کتونها اهمیت دارند. فرآورده که همان اکسیم است ، دارای پیوند دوگانه ی کربن- نیتروژن است. ترکیبات اکسیم در پزشکی کاربرد دارند به عنوان مثال به عنوان پادزهر برای عوامل عصبیnerve agent مورد استفاده قرار می گیرند. nerve agent ، مولکولهای acetylcholinesterase را بوسیله ی فرآیند phosphonylation غیرفعال می کند. ترکیبات اکسیم می توانند مولکولهای acetylcholinesterase را دوباره فعال نمایند. اکسیم perillaldehyde به عنوان شیرین کننده ی ساختگی در زاپن مورد استفاده قرار می گیرد که ۲۰۰۰ مرتبه شیرین تر از ساکارز می باشد. سیکلوهگزانون را میتوان از اکسایش سیکلوهگزانول توسط اسید کرومیک تهیه کرد. بدلیل اینکه کرومیک اسید نمی تواند به مدت طولانی پایدار بماند باید آنرا به مقدار لازم و تازه تهیه کرد. برای این کار از مخلوط سدیم بی کرومات یا پتاسیم بی کرومات و اسید سولفوریک استفاده می شود.
روش انجام ازمایش:
۲ گرم هیدروکسیل امین هیدرو کلرید را در ۲۰ میلی لیتر اب مقطر حل می کنیم .سپس به ان ۱۲ میلی لیتر هیدروکسید سدیم ۳ نرمال اضافه نمایید و پس از ان ۲ گرم سیکلو هگزانون به ان بیافزایید به محلول حاصل انقدر قطره قطره سود اضافه نمایید تا محلول خنثی شود . محلول را با هم زن انقدر بهم میزنیم تا رسوب زیادی تشکیل شود و تمام نوکلیوفیل با سیکلو هگزانون واکنش دهد.
عوامل خطا:
هیدروکسیل امین مایع در مجاورت هوا اکسیده می شود به دلیل نا پایدار بودن این ترکیب از نمک هیدروکسیل امین هیدرو کلرید استفاده می شود برای ازاد کردن نوکلئوفیل از نمک به باز نیاز داریم تا محلول خنثی شود اما اگر محیط قلیایی شود گروه به عنوان نوکلئوفیل رقابت می کند.اگر محیط اسیدی باشد موجب پروتونه شدنه سیکلو هگزانون شده و این ترکیب تمایلی به واکنش با نوکلئوفیل ندارد.
می دانید ساختار یک مولکول صابون به صورت زیر است:
CH3-(CH2)n-COO- +X در صابونهای جامد X یون سدیم و در صابونهای مایع پتاسیم و آمونیوم می باشد.
در تهیه ی صابون ابتدا یون هیدروکسید باز به عنوان نوکلئوفیل (هسته دوست) به کربن گروه کربنیل حمله کرده، پس از خارج شدن یک مولکول الکل، انیون اسید به صورت هیبرید رزونانس فوق، پایدار میگردد.
الکل نقش حلال را دارد. مواد اولیه برای تولید صابون چربی (مولکول آلی و غیر قابل حل در آب) و باز (مانند سود که در آب انحلال پذیر است) می باشند. برای اینکه واکنش بین دو ماده ی اولیه ، یعنی چربی و باز، بهتر صورت گیرد باید از یک حلال استفاده کرد که هر دو ماده ی اولیه را در خود حل نماید. الکل بسیار مفید است زیرا الکل مانند C2H5OH دارای یک سر هیدروکربنی و یک سر قطبی است و می تواند هر دو ماده ی اولیه را در خود حل کرده و درنتیجه واکنش بین ان دو سریعتر و کاملتر انجام گیرد.
افزایش نمک به دو علت انجام می شود. یکی اینکه یون سدیم به اندازه ی کافی در محیط باشد تا تام ئیدروژنهای اسیدی بتواند با یون سدیم جایگزین شود.محلول اشباع سدیم کلرید اضافه می شود تا طبق اصل لوشاتلیه کاتیونهای کافی برای انجام واکنش صابونی شدن فراهم باشد و از تعویض یونها اطمینان حاصل شود.
دوم برای جداسازی گلیسیرین است. صابون حاصل به شدت بوی چربی می دهد. زیرا صابون حاصل دارای مقدار زیادی گلیسیرین است، چنانچه بخواهند گلیسیرین آنرا جدا کنند، قبل از ریختن در قالب، صابون را به مدت 24 ساعت در محلول اشباع شده نمک طعام قرار میدهند، سپس قرص صابون را از درون ظرف خارج کرده و پس از شستن به قطعات کوچک تقسیم نموده، در هوا خشک میکنند.
آزمایش صابونی شدن را به صورت کامل در زیر ببینید . . . .
تهیه صابون
عمل هیدرولیز چربی یا روغن را اصطلاحا صابونی کردن مینامند. برای این کار، چربی (a) را با محلول سود حرارت میدهند. در نتیجه گلیسرین (b) و مخلوطی از نمک سدیم اسیدهای چرب (c) مطابق واکنش زیر حاصل میشود:
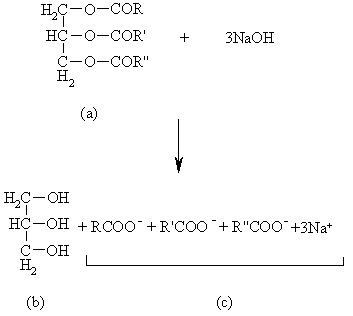 چربیها و روغنهای طبیعی استر اسیدهای آلیفاتیک یک ظرفیتی با تعداد اتمهای کربن زوج و گلیسرین میباشند که آنها را گلیسرید نیز مینامند. چربیها و روغنها به طور کلی دارای ساختمان (a) میباشند. چربیها جامد و روغنها مایع میباشند. نقطه ذوب چربیها بالاتر از نقطه ذوب روغنها است. این اختلاف بستگی به نوع و مقدار اسید مربوطه دارد. هرچه مقدار اسیدهای اشباع نشده در ساختمان یک چربی بیشتر باشد، نقطه ذوب پایین تری دارد. اگر چربی تنها از اسیدهای اشباع شده تشکیل شده باشد مانند پیه گوسفند و غیره نقطه ذوب بالا خواهد داشت.
چربیها و روغنهای طبیعی استر اسیدهای آلیفاتیک یک ظرفیتی با تعداد اتمهای کربن زوج و گلیسرین میباشند که آنها را گلیسرید نیز مینامند. چربیها و روغنها به طور کلی دارای ساختمان (a) میباشند. چربیها جامد و روغنها مایع میباشند. نقطه ذوب چربیها بالاتر از نقطه ذوب روغنها است. این اختلاف بستگی به نوع و مقدار اسید مربوطه دارد. هرچه مقدار اسیدهای اشباع نشده در ساختمان یک چربی بیشتر باشد، نقطه ذوب پایین تری دارد. اگر چربی تنها از اسیدهای اشباع شده تشکیل شده باشد مانند پیه گوسفند و غیره نقطه ذوب بالا خواهد داشت.
روغنهای نباتی مانند روغن زیتون، خرما، نارگیل و کرچک علاوه بر این که دارای اسیدهای چرب (اولئیک، استئاریک و پالمیتیک) هستند، اسیدهای اشباع نشده با چند پیوند دوگانه مانند اسید لینولئیک به فرمول زیر نیز در ساختمان آنها شرکت میکنند.
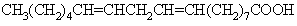
مکانیزم عمل هیدرولیز استر را در محیط بازی میتوان به صورت زیر نوشت:
ابتدا یون هیدروکسید به عنوان نوکلئوفیل (هسته دوست) به کربن گروه کربنیل حمله کرده، پس از خارج شدن یک مولکول الکل، انیون اسید به صورت هیبرید رزونانس فوق، پایدار میگردد.
50 گرم چربی را در یک بشر 250 میلی لیتری ریخته و به طور ملایم آنرا حرارت دهید تا ذوب شود (دما نباید از 70 درجه بالاتر برود).
در حالیکه چربی را حرارت میدهید ضمن به همزدن مداوم محلول سود (7گرم در 50 میلی لیتر آب) را در قسمتهای 5 میلی لیتر به چربی اضافه کنید. پس از افزودن اولین 5 میلی لیتر سود، زمان اضافه نمودن 5 میلی لیتر بعدی وقتی است که سود اضافه شده قبلی تقریبا مصرف شده باشد. (برای اطمینان از مصرف سود نوک اسپاتول را در بشر فرو برده و یک قطره معرف فنل فتالئین روی آن بچکانید، چنانچه رنگ آن فورا ارغوانی شد دلیل آن است که هنوز سود در محیط وجود دارد و باید به هم زدن را ادامه داد).
پس از افزودن آخرین قسمت سود، آنقدر به هم بزنید تا صابون یک حالت کشدار به خود بگیرد (بوی صابون در این حالت به خوبی استشمام میشود.) صابون حاصل را در قالب ریخته و بگذارید یک هفته بماند تا عمل صابونی شدن کامل شود. صابون حاصل دارای مقدار زیادی گلیسیرین است، چنانچه بخواهند گلیسیرین آنرا جدا کنند، قبل از ریختن در قالب، صابون را به مدت 24 ساعت در محلول اشباع شده نمک طعام قرار میدهند، سپس قرص صابون را از درون ظرف خارج کرده و پس از شستن به قطعات کوچک تقسیم نموده، در هوا خشک میکنند.
در یک بالن، cc50 روغن مایع را با cc40 اتانول و gr3 پتاسیم هیدروکسید ریخته و بمدت نیم ساعت رفلاکس کنید. پس از اتمام این مدت چند قطره از مخلوط را در مقدار کمی آب حل کنید که اگر قطره روغنی روی آب قرار نگرفت واکنش پایان یافته و اگر روغن در سطح آب مشاهده شد عمل رفلاکس را به مدت 15 دقیقه دیگر ادامه دهید. سپس الکل موجود در مخلوط را به وسیله تقطیر ساده جدا کنید و ماده باقیمانده در بالن را در cc 75 آب مقطر گرم حل کنید. دقت کنید که حتما الکل موجود در بالن از مخلوط خارج شود سپس آزمایش زیر را انجام دهید.
الف) مقدار 25 میلی لیتر محلول به دست آمده را به 25 میلی لیتر آب نمک اشباع به آهستگی اضافه کنید مخلوط را صاف کرده و ماده جامد که صابون میباشد روی کاغذ صافی میماند. آنرا با آب نمک اشباع بشوئید و صابون را در روی یک ظرف شیشه ای پهن کنید.
ب) مقدار 10 میلی لیتر آب شهر را با 10 میلی لیتر محلول صابون مخلوط کرده تکان دهید و نتیجه را گزارش کنید.
منبع:http://sarvchemical.mihanblog.com
آمین های استیل دار شده آروماتیك به عنوان مسكن درد اهمیت ویژه ای دارند و در زمره داروهایی كه بدون نسخه پزشك خریداری و مورد استفاده قرار می گیرند. استانیلید ، فناستین و استامینوفن مسكن های ملایم و كاهش دهنده تب می باشند.
استانیلید خالص سمی است و از راه پوست به بدن صدمه می زند. از استانیلید در تهیه داروها و رنگها و همچنین به عنوان تثبیت کننده به محلول آب اکسیژنه استفاده می شود.
استانیلید یا همانN –فنیل استامید دارای فرمول C6H5NHCOCH3 بوده و جزء دسته آمین های نوع دوم است. با وجود آنكه از این ماده در تهیه داروها استفاده می شود.
مصرف زیاد یا طولانی استانیلید سبب بیماری خونی بنام مت هموگلوبینمیا می شود. در این بیماری ، اتم آهن مركزی هموگلوبین از حالت آهن(II) به حالت آهن(III) تبدیل می شود و مت هموگلوبین می دهد. مت هموگلوبین نمی تواند حمل اكسیژن را در خون انجام دهد و نتیجه آن نوعی كم خونی است كه با كاهش هموگلوبین یا از دست رفتن سلول های قرمز همراه است.
از واكنش آمین با اسید انیدرید ، آمید تشكیل می شود. استیل دار شدن آمین از راه های متفاوتی انجام می شود كه عبارتند از واكنش آمین با استیك انیدرید ، استیل كلرید و یا استیك اسید گلاسیال. استفاده از استیك انیدرید برای سنتز آزمایشگاهی ارجحیت دارد. زیرا خلوص محصول و بازده آن مناسب است.
استیل دار کردن آنیلینبا استفاده از استیک انیدریددر محیط اسیدی به سادگی و با راندمان نسبتا خوبی امکانپذیر است. عامل استیله کننده در این آزمایش استیک انیدریدمیباشد.
اگر یک گروه OH به استانیلیداضافه شود استامینوفن تولید می شود.
روش کار
10 سی سی آنیلینرا به یک بشرحاوی محلولی از 9 سی سی HClغلیظ در 250 میلی لیتر آب اضافه کنید. مخلوط را کاملا به هم بزنید تا آنیلینحل شود. در صورتی که محلول رنگی بود حدود 2 گرم کربن فعال به آن اضافه کنید و 2 دقیقه بجوشانید و صاف کنید تا محلول شفاف بدست آید.
محلولی از 17 گرم سدیم استاتدر 50 سی سی آب تهیه کنید.
به محلول آنیلیندر اسید کلریدریک (محلول اول) 13 سی سی استیک انیدریداضافه کرده و به هم بزنید تا محلول همگن به دست آید. محلول حاصل را بلافاصله به بشرحاوی محلول سدیم استاتاضافه کنید. بشر را در حمام یخ گذاشته و بشدت به هم بزنید تا کریستالهای بیرنگ استانیلیدجدا شوند. کریستالها را صاف کرده و با آب سرد بشویید و آنها را خشک کنید.
در صورتی که استانیلیدرنگی باشد نشانه ناخالصی است. برای خالص سازی، آنرا در حداقل آب داغ تبلور مجددنمائید.
راندمان و نقطه ذوب را تعیین کنید.
منبع:http://sarvchemical.mihanblog.com
آزمایش شماره1
(Melting Point)نقطه ذوب
هدف : تعیین نقطه ذوب جامدات به روش میکرویی
مقدمه : نقطه ذوب یکی از خواص فیزیکی است که از آن می توان در شناسایی اجسام و در تعیین خلوص
اجسام استفاده کرد.هر جسم جامد در یک دماي معین و تقریبا ثابت ذوب می شود. بنابراین با اندازه گیري
نقطه ذوب یک جسم مجهول و مراجعه به جداول ثابت هاي فیزیکی قادر خواهیم بود جسم را شناسایی و یا
1 می باشد) oC 0/5 تا oC خلوص انرا تعیین کنیم. (گستره تغییرات
تئوري : در ساختمان کریستال یونها و یا مولکولها به وسیله نیروهاي نگه دارنده به صورت کاملا منظم در
کنار یکدیگر قرار گرفته اند.این نیروها انرژي شبکه اي کریستال را تشکیل می دهند. ترکیبات یونی مانند
نمکها داراي انرژي شبکه اي زیاد، ترکیبات قطبی (مانند الکلها)از لحاظ دارا بودن انرژي در سطح متوسط
تري بوده و ترکیبات غیر قطبی (مانند الکانها) انرژي شبکه اي فوق العاده کمی زا دارا می باشند.اگر یک
ترکیب کریستالی حرارت داده شود در درجه حرارت معینی که بستگی به نوع کریستال دارد انرژي حرارتی
داده شده بر انرژي شبکه اي کریستال غلبه کرده و باعث می گردد که کریستال ذوب گردد.نقطه ذوب
١- درجه حرارتیاست که درآن فاز جامد و فاز مایعبا یکدیگر درحال تعادل هستند.در شکل ١
رابطه بین دما و حرارت کل داده شده به یک ماده خالص نشان داده شده است. توجه کنید که حرارت با
سرعت ثابتی به ترکیب داده می شود و بنابراین زمانی که صرف گرم کردن می شود معیاري براي سنجش
حرارت داد شده است.
١- شکل١
دماي دادهشده
دماي مشاهدهشده
مایع جامدو مایع
جامد
2
در درجه حرارت پایین (زیر نقطه ذوب) ترکیب به صورت فاز جامد وجود دارد. با گرما دادن به جسم درجه
حرارت تا زمانی که اولین قطره مایع ظاهر می شود به صورت خطی بالا می رود سپس ثابت می ماند تا تمام
جسم ذوب گردد، بعد از آن درجه حرارت مایع با افزایش گرما زیاد می گردد.همانطور که مشخص است
چنانچه در نقطه ذوب به مخلوط فازهاي جامد و مایع یک جسم خالص حرارت داده شود، ازدیادي در درجه
حرارت صورت نمی گیرد تا تمام جامد به مایع تبدیل شود(ذوب). چناچه حرارت از چنین مخلوطی دور
شود درجه حرارات تنزل نمی کند تا تمام مایع به جامد تبدیل شود(منجمد شود). بنابراین نقطه ذوب و
انجماد یک جسم خالص یکسان است.
بین نقطه ذوب و ساختمان مولکول یک ماده ارتباط وجود دارد.به طور تقریب می شود پیش بینی کرد که
اجسام با مولکولهاي متقارن در دماي بالاتر ذوب می شوند تا آنهایی که ساختمان با تراکم کمتري دارند.
مثلا نرمال آلکانها نقطه ذوب پایین تري نسبت به ایزو الکانها با همان مقدار کربن دارند. نقطه ذوب با درجه
تجمع یک ترکیب افزایش می یابد به این دلیل استرها که قابلیت تشکیل پیوند هاي هیدروژنی ندارند در
مقایسه با کربوکسیلیک اسیدها در حرارت پایین تري ذوب می شوند.
نقطه ذوبمخلوط ها :
ناخالصیهاي جزئی نقطه ذوب را به طور قابل ملاحظه اي پایین می آورند، هرچه مقدار ناخالصی بیشتر باشد
نقطه ذوب کمتر می شود.از نزول نقطه ذوب که در اثر ورود ناخالصی در ترکیب خالص به وجود می آید می
توان در شناسایی ترکیب استفاده کرد. این روش مهم به اندازه گیري نقطه ذوب معروف است.مثلا فرض
133 ذوب می شود و فکر می کنید که اوره یا ترانس بینامیک اسید باشد (هر دو در oC کنید که ترکیبی در
133 ذوب می شوند)چنانچه این ترکیب با اوره کاملا مخلوط شود و معلوم شود که نقطه ذوب مخلوط oC
حاصل از ترکیب خالص یا اوره خالص کمتر است در این صورت اوره مانند یک ناخالصی عمل کرده و ترکیب
نمی تواند اوره باشد و در صورت یکسان شدن نقطه ذوب مخلوط با نقطه ذوب ترکیب و اوره خالص پیش
بینی می شود که ترکیب اوره باشد، غالبا این روش را در مواقعی بکار می بریم که با مشکل شناسایی روبه رو
باشیم و نمونه اجسام احتمالی را در دست داشته باشیم. همچنین براي اینکه تطابق دو ماده با نقطه ذوب
یکسان را آزمایش کنیم از خاصیت فوق استفاده میکنیم.براي این منظور مقدار مساوي از دو جسم راخوب
سائیده و حرارت می دهند.اگر نقطه ذوب این مخلوط تغییر نکند بنابراین مربوط به همان ماده می شود
واگر نقطه ذوب نزول کند مربوط به دو ماده مختلف است.
در آزمایش امروز نقطه ذوب را به روش میکرویی اندازه می گیریم. در این آزمایش مقداري از ماده جامد را
درون لوله موئینی که یک سر آن بسته شده می ریزند و لوله را به دماسنج می بندند. این مجموعه را در
3
حمام گلیسرین فرو برده و حمام را حرارت می دهند. زمانی که اولین قطره مایع ظاهر شد درجه حرارت
دماسنج را می خوانند. این مقدار نقطه ذوب ماده جامد را به صورت تقریبی نشان می دهد. معمولا با چنین
روشی و با موادي که درجه خلوص بالایی را دارا نمی باشند نقطه ذوب دقیقی به دست نمی آید.دقت اندازه
گیري نقطه ذوب با این روش بین چند دهم درجه تا یک درجه است.
از مایعاتی مانند: گلیسرین، پارافین و اتیلن گلیکول می توان به عنوان حمام هاي نقطه ذوب که گرماي لازم
را به طور یکنواخت به لوله موئین منتقل می کنند، استفاده کرد.
محدوده نقطهذوب عبارت است از درجه حرارتی که در آن اولین قطره مایع ظاهر شده تا درجه حرارتی
که آخرین کریستال جامد ناپدید می شود.
روش کار :
مقداري از نمونه را پودر کرده روي یک سطح تمیز و تخت بریزید.یک سر لوله موئین را به کمک حرارت
مسدود کرده و با فشار دادن انتهاي باز لوله موئین روي توده نمونه مقدار کمی از آن را بردارید. سپس لوله
موئین را به صورت عمودي نگهدارید به طوریکه دهانه لوله به طرف بالا باشد و انتهاي مسدود لوله موئین را
به آرامی روي میز آزمایشگاه بزنید تا کریستالها به ته لوله موئین منتقل شوند. در صورت لزوم این کار را
2 برسد.لوله موئین را به یک دماسنج mm تکرار کنید تا زمانی که ارتفاع ستون کریستالها در لوله به حدود
ببندید و هر دو اینها را توسط گیره در حمام فرو برید. حرارت دادن را شروع کنید. میزان حرارت باید طوري
باشد که در هر 30 تا 60 ثانیه دما بیش از یک درجه بالا نرود. پیوسته حمام را به وسیله همزن هم بزنید.
همین که اولین قطره مایع ظاهر شد دما را یادداشت کنید سپس هنگامیکه آخرین ذره جامد نیز ناپدید شد
دما را ثبت کنید. محدوده نقطه ذوب را گزارش کنید.
4
آزمایش شماره2
(Boiling Point) نقطه جوش
(Semimicro) هدف : تعیین نقطه جوش مایعات با استفاده از روش نیمه میکرویی
مقدمه : به طور کلی ترکیبات آلی به وسیله ترکیب عنصري و جرم مولکولیشان مشخص نمی شوند، بنابراین
بایستی از خواص دیگر به ویژه خواص فیزیکی این ترکیبات جهت شناسایی آنها استفاده کرد.
و ضریب شکست نور (d) دانسیته ،(mp)نقطه ذوب ،(bp)مهمترین خواص فیزیکی عبارتند از نقطه جوش
ممکن است چند ترکیب از نظر یک یا دو خاصیت فیزیکی ثابتهاي یکسانی داشته باشند ولی بسیار .(n)
اتفاقی خواهد بود که بیش از یک ترکیب در تمام این خواص ثابتهاي یکسانی نشان دهد. بنابراین به نظر می
رسد که جدول ثابتهاي فیزیکی براي تشخیص جسم بسیار مفید باشد.به علاوه با مشاهده نقطه جوش یا
ذوب ممکن است اطلاعاتی در مورد جسم مورد مطالعه بدست آید.خواص دیگر مانند رنگ، بو و شکل بلور
نیز مورد استفاده هستند.
تئوري : مولکولهاي مایع می توانند در هر دمایی از سطح مایع جدا شوند(تبخیر شوند)و در فاز گازي وارد
گردند. زمانی که یک مایع در ظرف سر بسته اي قرار گیرد مولکولهاي مایع به صورت بخار از سطح مایع جدا
می شوند و مولکولهاي بخار به داخل مایع باز می گردند.سر انجام حالت تعادلی ایجاد می شود که در آن
سرعت مولکولهایی که از سطح مایع خارج می شوند با سرعت مولکولهایی که به داخل مایع باز می گردند با
هم برابر می شود. مولکولهاي موجود در فاز بخار فشاري را اعمال می کنند که به نام فشار بخار مایع نامیده
می شود. فشار بخار یک مایع معین به درجه حرارت آن بستگی داشته و مقدار آن در درجه حرارت معین
مقدار ثابتی می باشد. چنانچه درجه حرارت یک مایع را تا نقطه اي بالا ببریم که در آن فشار بخار مایع
دقیقا برابر فشار محیط (اتمسفر) گردد مایع شروع به جوشیدن می کند. نقطهجوش یک مایع درجه
حرارتی استکه در آندرجه حرارت فشار بخار مایع برابرفشار اتمسفر شود. مثلا اگر فشار
760 است.اگر mmHg 100 میجوشد، زیرا در این دما فشار بخار آب درست oC 760 باشد آب در mmHg
فشار اتمسفر کاهش یابد درجه حرارت لازم براي رساندن فشار بخار به فشار اتمسفر نیز کاهش می یابد.
بدین ترتیب نقطه جوش خیلی بیشتر از نقطه ذوب نسبت به تغییرات فشار جو حساس می باشد.
از این رو به خاطر آنکه ممکن است نقطه جوش به عنوان یک عامل مشخصه شناسایی اجسام به کار می
رود. لازم است که فشاري که در آن نقطه جوش تعیین شده قید گردد. یک سري هم ردیف
از ترکیباتی مانند هیدرو کربن ها یک رفتار معین در روابط نقطه جوش(یا فشار بخار) (Homologous)
5
باجرم مولکولی نشان می دهد.هرچه مولکول بزرگتر باشد انرژي جنبشی بیشتري لازم است تا به مولکولها
اجازه خروج از مایع را بدهد و بنابراین نقطه جوش افزایش می یابد.
یکی از راههاي تعیین نقطه جوش مایعات استفاده از روش (تقطیر) است اما در مواردي که مقدار کافی از
مایع در دسترس نیست نمی توان این روش را براي اندازه گیري نقطه جوش به کار برد. (به طور کلی زمانی
10 یا بیشتر باشد).براي cc از تقطیر براي تعیین نقطه جوش استفاده می شود که مقدار مایع مورد آزمایش
یا نیمه میکرویی استفاده می کنند در این روش یک Semimicro حل این مشکل در آزمایشگاه از روش
طرف لوله موئین را بسته و آنرا از طرف باز در یک لوله آزمایش وارونه می اندازند. مقدار کمی از مایع مورد
آزمایش را درون لوله آزمایش حاوي لوله موئین ریخته و به آن یک دماسنج وصل می کنند.با حرارت دادن
این مجموعه در حمام روغن دما افزایش پیدا کرده و موجب انبساط حجمی مولکولهاي هواي داخل لوله
موئین می شود.به این دلیل جریان مداومی از حبابهاي هوا از انتهاي لوله موئین خارج می شود.با قطع
حرارت و سرد کردن حمام در دماي معینی (نقطه جوش)به دلیل برابر شدن فشار بخار مایع و فشار هواي
درون لوله موئین خروج حبابها متوقف شده و مایع درون لوله آزمایش از لوله موئین بالا می رود. این دما
ادامه مطلب...