
|
آلکانها، هیدروکربنهایی هستند که در آنها هر اتم کربن با ۴ پیوند به ۴ اتم هیدروژن یا کربن میچسبند. در واقع پیوند دو یا سه گانه بین اتمهای کربن وجود ندارد. فرمول کلی آلکانها CnH۲n+۲ است. سادهترین آلکان، متان (CH۴) است که بخش عمده گاز طبیعی را تشکیل میدهد. اتان (C۲H۶)، پروپان (C۳H۸) و بوتان (C۴H۱۰) دیگر آلکانهای گازی هستند. پنتان (C۵H۱۲)، هگزان (C۶H۱۴)، هپتان (C۷H۱۶) و اکتان (C۸H۱۸) مهمترین آلکانهای مایع هستند.
نامگذاری آلکانها را موسسه آیوپاک انجام میدهد.
تعداد ایزومرها به ترتیب ۱، ۱. ۱، ۲، ۳، ۵، ۹، ۱۸، ۳۵، ۷۵، ۱۵۹، ۳۵۵،....
تا به حال فرمولی برای تعداد آلکانها پیدا نشده است . فرمول زیر برای آلکانهایی است که دارای ۴ تا ۷ کربن هستند. 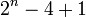
آلکانها میتوانند راست زنجیر یا شاخه دار باشند . مولکولهایی که فرم مولکولی یکسان دارند، اما آرایش اتمها در آنها متفاوت است . هم پاریاایزومر مینامند . آلکانهایی که چهار یا تعداد بیش تری اتم کربن داشته باشند دارای ایزومر هستند . همهٔ آلکانها، گازها، مایعها یا جامدهایی بی رنگ هستند که با افزایش اعداد کربن نقطه جوش و گرانوری(گرانوری یک مایع،میزان عدم تعادل آن رابرای جاری شدن معین می کند) آنها افزایش مییابد . همهٔ آلکانها در هوا با شعله زرد – آبی تمیزی میسوزند .
خواص فیزیکی آلکانها از همان الگوی خواص فیزیکی متان پیروی میکند و با ساختار آلکانها سازگار است. یک مولکول آلکان فقط بهوسیله پیوندهای کووالانسی برپا نگه داشته شدهاست. این پیوندها یا دو اتم از یک نوع را بهم متصل میکنند و در نتیجه، غیر قطبیاند، یا دو اتم را که تفاوت الکترونگاتیوی آنها بسیار کم است، به یکدیگر ربط میدهند و در نتیجه قطبیت آنها کم است. به علاوه، این پیوندها به طریقی بسیار متقارن جهت گرفتهاند، بطوری که این قطبیهای پیوندی نیز یکدیگر را خنثی میکنند.
در نتیجه یک مولکول آلکان یا غیر قطبی است یا قطبیت بسیار ضعیفی دارد. نیروهایی که مولکولهای غیر قطبی را گرد هم نگه میدارند (نیروهای واندروالسی) ضعیف هستند و گستره بسیار محدودی دارند. این نیروها فقط بین بخشهایی از مولکولهای مختلف که با یکدیگر در تماس نزدیک باشند، یعنی بین سطوح مولکولها، عمل میکنند. بنابراین در یک خانوداه معین، انتظار داریم که هر اندازه مولکول بزرگتر و شود در نتیجه سطح تماس آنها بیشتر شود، نیروهای بین مولکولی نیز قویتر میشوند.
دمای جوش و ذوب با افزایش شمار اتمهای کربن، زیاد میشود. فرایند جوشیدن و ذوب شدن، مستلزم فایق آمدن بر نیروهای بین مولکولی در یک مایع و یک جامد است. دمای جوش و دمای ذوب بالا میرود، زیرا این نیروهای بین مولکولی با بزرگ شدن مولکولها افزایش مییابند.
منبع:ویکی پدیا

